S rostoucím rozdílem elektronegativit se zvyšuje pravděpodobnost výskytu vazebných elektronů u elektronegativnějšího vazebného partnera a s tím roste i polarita vazby. Pokud je rozdíl elektronegativit dostatečně vysoký (udává se hodnota Δχ = 1,7), vazbu již považujeme za iontovou.předáním jednoho nebo více elektronů jinému atomu (vzniká tak vazba iontová, která je všesměrová), společným sdílením jednoho nebo více elektronů s jiným atomem (vzniká tak vazba kovalentní, která je směrově specifická).Iontová vazba je typ chemické vazby, ve které jeden atom získá jeden nebo více elektronů na úkor druhého atomu. Vzniká, pokud rozdíl elektronegativit vázaných atomů je velký; obvykle se uvažuje, že iontová vazba vzniká při rozdílu elektronegativit Δ χ > 1,7 .
Jak poznat kovovou vazbu : Kovová vazba je jedním z typů vazeb, mezi které dále patří kovalentní a iontová vazba. Od kovalentní vazby se kovová vazba liší především nedostatek elektronů schopných vazby. Kovovou vazbu tak lze charakterizovat jako extrémně delokalizovanou komunální formu kovalentní vazby s nedostatkem elektronů.
Jaké vlastnosti mají sloučeniny s iontovou vazbou
Za pokojové teploty jsou iontové sloučeniny pevné látky s krystalovou strukturou. Mají vysoké teploty tání a varu (vysoká disociační energie) a špatně vedou elektrický proud. Iontové sloučeniny jsou dobře rozpustné ve vodě a dalších polárních rozpouštědlech.
Jaké jsou typy vazeb : Druhy vazeb
Kovová vazba.
Kovalentní vazba.
Iontová vazba.
Vazba sigma – σ
Vazba pí – π
Jednoduchá vazba.
Dvojná vazba.
Trojná vazba.
SOLNÉ-IONTOVÉ VAZBY
Lze je rozrušit působením roztoku soli amoniaku. V kadeřnické praxi se tyto vazby narušují při barvení, odbarvování i chemické preparaci (z rovného vlasu se stává kudrnatý). Iontové sloučeniny jsou sloučeniny tvořené z iontů. Popis reakce: Elektricky neutrální atom sodíku předá (ztratí) při sloučení s atomem chloru jeden valenční elektron a vytvoří kladně nabitou částici – kation Na+. elektricky vodivý (naruší se pravidelné uspořádání iontů a ionty se volně pohybují).
Jaká je podstata kovové vazby
Kovová vazba vzniká mezi atomy kovu v tuhém stavu a je způsobena elektrostatickou přitažlivostí kationtů kovů a volně se pohybujících valenčních elektronů. Zjednodušeně chápaná kovová mřížka je znázorněna na Obr. 18-1. Předpokládá se, že v krystalu kovu jsou pravidelně uspořádaná jádra atomů kovu (včetně elektronů tzv.Iontové sloučeniny jsou sloučeniny tvořené z iontů. Popis reakce: Elektricky neutrální atom sodíku předá (ztratí) při sloučení s atomem chloru jeden valenční elektron a vytvoří kladně nabitou částici – kation Na+. elektricky vodivý (naruší se pravidelné uspořádání iontů a ionty se volně pohybují).Obecně platí, že kovalentní vazby jsou mezi atomy dvou nekovových prvků (nekov-nekov), iontové vazby mezi kovem a nekovem (kov-nekov) a kovová vazba je mezi atomy kovů (kov-kov – v tomto případě se jedná o vysoký počet atomů kovu vzájemně sdílejících elektrony). Nepolární vazba je typ kovalentní vazby, který vzniká mezi atomy, jejichž rozdíl elektronegativit je menší než 0,4. Nepolární vazba je charakterizována stejnoměrným rozložením hustoty vazebných elektronů. Příkladem ideální nepolární vazby jsou molekuly složené ze stejných atomů, např. O2, N2, F2, …
Co je kovová vazba : Kovová vazba vzniká mezi atomy kovu v tuhém stavu a je způsobena elektrostatickou přitažlivostí kationtů kovů a volně se pohybujících valenčních elektronů.
Co určuje vaznost atomů : ELEKTRONEGATIVITA X je schopnost atomu přitahovat vazebné elektrony (elek- trony účastnící se vazby). Elektronegativnější atom (atom s vyšší X) ve vazbě k sobě poutá elektronový pár silněji než druhý elektropozitivnější atom (atom s nižší X).
Co to je ionizace
Ionizace je proces, při kterém se z elektricky neutrálního atomu nebo molekuly stává iont. Pojem „ionizace“ také označuje stav hmoty, která obsahuje ionty. Ionizační energie neutrálních prvků. Opačným dějem k ionizaci je rekombinace. Vazebný elektronový pár sdílený mezi atomy stejné nebo velmi podobné elektronegativity (rozdíl do 0,4) tvoří nepolární kovalentní vazbu (např. H–H nebo C–H), zatímco v případě většího rozdílu (0,4-1,7) se jedná o vazbu kovalentní polární (např.Polární vazba se nachází mezi atomy s rozdílem hodnot elektronegativity v inter- valu 0,4 < ∆X < 1,7. Větší rozdíl hodnot elektronegativity má za následek, že jsou vazebné elektrony posunuty více právě směrem k atomu s vyšší hodnotu elektro- negativity.
Co je Atlasová vazba : Atlasová vazba:
Atlasová vazba vzniká pravidelným rozmístěním vazných bodů, tak aby se vzájemně nedotýkaly. Každá nit ve střídě vazby je provázána pouze jednou. Nejčastěji se používá atlas pětivazný, který má hladký a rovný povrch. Střída vazby je tvořena pěti nitěmi osnovními a pěti nitěmi útkovými.
Antwort Kdy je vazba iontová? Weitere Antworten – Jak poznat iontovou vazbu
S rostoucím rozdílem elektronegativit se zvyšuje pravděpodobnost výskytu vazebných elektronů u elektronegativnějšího vazebného partnera a s tím roste i polarita vazby. Pokud je rozdíl elektronegativit dostatečně vysoký (udává se hodnota Δχ = 1,7), vazbu již považujeme za iontovou.předáním jednoho nebo více elektronů jinému atomu (vzniká tak vazba iontová, která je všesměrová), společným sdílením jednoho nebo více elektronů s jiným atomem (vzniká tak vazba kovalentní, která je směrově specifická).Iontová vazba je typ chemické vazby, ve které jeden atom získá jeden nebo více elektronů na úkor druhého atomu. Vzniká, pokud rozdíl elektronegativit vázaných atomů je velký; obvykle se uvažuje, že iontová vazba vzniká při rozdílu elektronegativit Δ χ > 1,7 .
Jak poznat kovovou vazbu : Kovová vazba je jedním z typů vazeb, mezi které dále patří kovalentní a iontová vazba. Od kovalentní vazby se kovová vazba liší především nedostatek elektronů schopných vazby. Kovovou vazbu tak lze charakterizovat jako extrémně delokalizovanou komunální formu kovalentní vazby s nedostatkem elektronů.
Jaké vlastnosti mají sloučeniny s iontovou vazbou
Za pokojové teploty jsou iontové sloučeniny pevné látky s krystalovou strukturou. Mají vysoké teploty tání a varu (vysoká disociační energie) a špatně vedou elektrický proud. Iontové sloučeniny jsou dobře rozpustné ve vodě a dalších polárních rozpouštědlech.
Jaké jsou typy vazeb : Druhy vazeb
SOLNÉ-IONTOVÉ VAZBY
Lze je rozrušit působením roztoku soli amoniaku. V kadeřnické praxi se tyto vazby narušují při barvení, odbarvování i chemické preparaci (z rovného vlasu se stává kudrnatý).

Iontové sloučeniny jsou sloučeniny tvořené z iontů. Popis reakce: Elektricky neutrální atom sodíku předá (ztratí) při sloučení s atomem chloru jeden valenční elektron a vytvoří kladně nabitou částici – kation Na+. elektricky vodivý (naruší se pravidelné uspořádání iontů a ionty se volně pohybují).
Jaká je podstata kovové vazby
Kovová vazba vzniká mezi atomy kovu v tuhém stavu a je způsobena elektrostatickou přitažlivostí kationtů kovů a volně se pohybujících valenčních elektronů. Zjednodušeně chápaná kovová mřížka je znázorněna na Obr. 18-1. Předpokládá se, že v krystalu kovu jsou pravidelně uspořádaná jádra atomů kovu (včetně elektronů tzv.Iontové sloučeniny jsou sloučeniny tvořené z iontů. Popis reakce: Elektricky neutrální atom sodíku předá (ztratí) při sloučení s atomem chloru jeden valenční elektron a vytvoří kladně nabitou částici – kation Na+. elektricky vodivý (naruší se pravidelné uspořádání iontů a ionty se volně pohybují).Obecně platí, že kovalentní vazby jsou mezi atomy dvou nekovových prvků (nekov-nekov), iontové vazby mezi kovem a nekovem (kov-nekov) a kovová vazba je mezi atomy kovů (kov-kov – v tomto případě se jedná o vysoký počet atomů kovu vzájemně sdílejících elektrony).
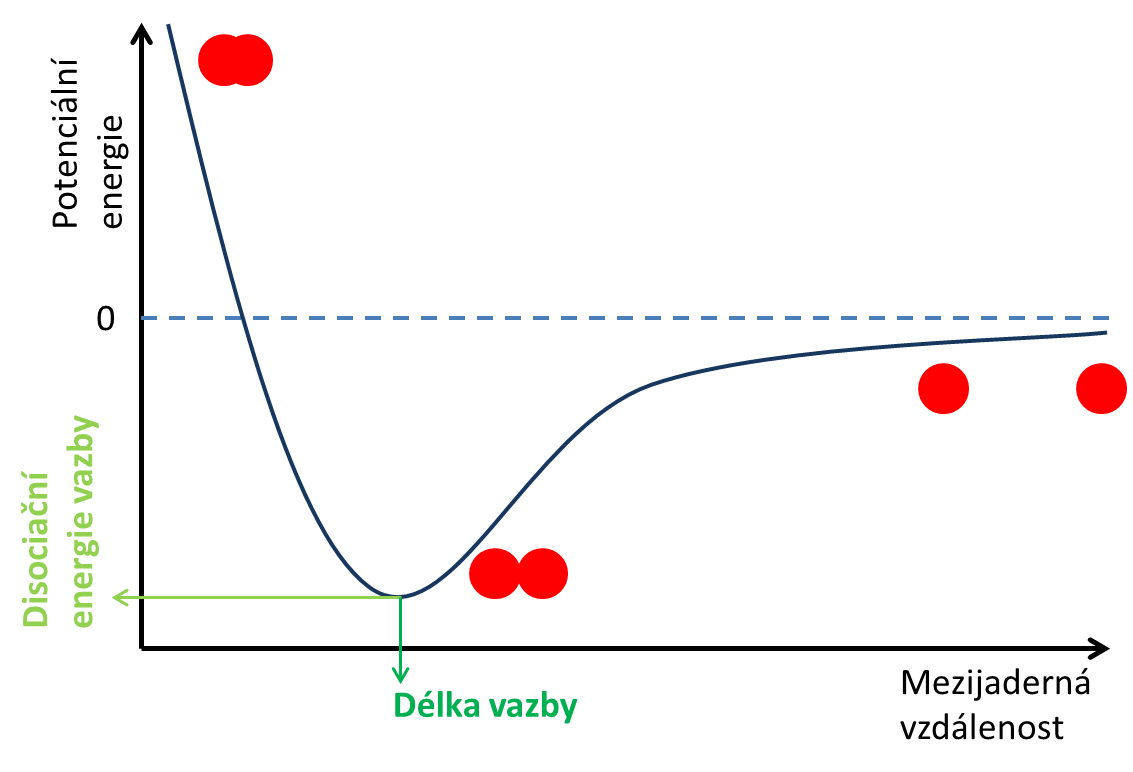
Nepolární vazba je typ kovalentní vazby, který vzniká mezi atomy, jejichž rozdíl elektronegativit je menší než 0,4. Nepolární vazba je charakterizována stejnoměrným rozložením hustoty vazebných elektronů. Příkladem ideální nepolární vazby jsou molekuly složené ze stejných atomů, např. O2, N2, F2, …
Co je kovová vazba : Kovová vazba vzniká mezi atomy kovu v tuhém stavu a je způsobena elektrostatickou přitažlivostí kationtů kovů a volně se pohybujících valenčních elektronů.
Co určuje vaznost atomů : ELEKTRONEGATIVITA X je schopnost atomu přitahovat vazebné elektrony (elek- trony účastnící se vazby). Elektronegativnější atom (atom s vyšší X) ve vazbě k sobě poutá elektronový pár silněji než druhý elektropozitivnější atom (atom s nižší X).
Co to je ionizace
Ionizace je proces, při kterém se z elektricky neutrálního atomu nebo molekuly stává iont. Pojem „ionizace“ také označuje stav hmoty, která obsahuje ionty. Ionizační energie neutrálních prvků. Opačným dějem k ionizaci je rekombinace.

Vazebný elektronový pár sdílený mezi atomy stejné nebo velmi podobné elektronegativity (rozdíl do 0,4) tvoří nepolární kovalentní vazbu (např. H–H nebo C–H), zatímco v případě většího rozdílu (0,4-1,7) se jedná o vazbu kovalentní polární (např.Polární vazba se nachází mezi atomy s rozdílem hodnot elektronegativity v inter- valu 0,4 < ∆X < 1,7. Větší rozdíl hodnot elektronegativity má za následek, že jsou vazebné elektrony posunuty více právě směrem k atomu s vyšší hodnotu elektro- negativity.
Co je Atlasová vazba : Atlasová vazba:
Atlasová vazba vzniká pravidelným rozmístěním vazných bodů, tak aby se vzájemně nedotýkaly. Každá nit ve střídě vazby je provázána pouze jednou. Nejčastěji se používá atlas pětivazný, který má hladký a rovný povrch. Střída vazby je tvořena pěti nitěmi osnovními a pěti nitěmi útkovými.