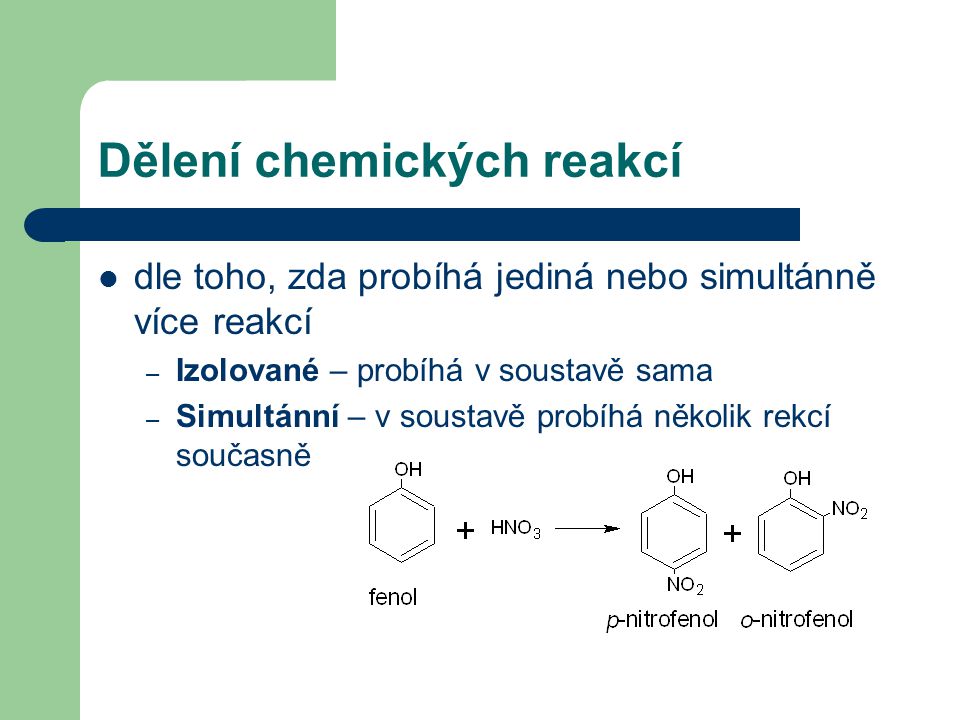
se zabývá rychlostí chemických reakcí.- katalyzátor reakci urychluje, inhibitor zpomaluje. V některé literatuře je možno se setkat také s pojmy „katalyzátor pozitivní“ (urychluje reakci) a „katalyzátor negativní“ (zpomaluje reakci, tedy inhibitor). Katalyzátor (inhibitor) se při reakci nespotřebovává). vratné a probíhají až do ustálení rovnovážného stavu.Závislost koncentrace výchozích látek na rychlost chemické reakce je charakterizována Guldberg-Waagovým zákonem: Rychlost chemických reakcí je přímo úměrná koncentraci výchozích látek (eduktů). Z tohoto vztahu vyplývá, že chemická reakce probíhá tím rychleji, čím jsou edukty koncentrovanější.
Jak závisí rychlost reakce na teplotě : Při zvýšení teploty o 10 °C se hodnota rychlostní konstanty, a tím i rychlost reakce, zvyšuje zpravidla dvakrát až čtyřikrát.
Kdo se zabyva rychlostí chemických reakcí
Chemická kinetika studuje rychlosti a mechanismy chemických reakcí. Rychlost reakce je měřítkem, jak rychle vznikají produkty a zanikají reagující látky. Mechanismus reakce je podrobný popis posloupnosti jednotlivých kroků, které se odehrávají na úrovni molekul, vedoucích od reaktantů k produktům.
Jak určit rád reakce : Řád reakce je číslo, které určuje, jakým způsobem závisí rychlost na koncentraci. Určujeme řády dílčí vždy vůči jen některým reaktantům a řád celkový, který je součtem všech dílčích řádů vůči jednotlivým reaktantům.
Studiem reakční rychlosti se zabývá chemická kinetika. Aby mohly spolu dvě či více látek reagovat, musí dojít ke srážce jejich molekul. Pravděpodobnost srážky se zvyšuje s rostoucí teplotou, tlakem a koncentrací látek. Endotermická (endotermní) reakce (z řeckého ἔξω endo „dovnitř“ a θερμός thermós „teplý, horký, vyhřívaný“) je chemická reakce, při níž se energie spotřebovává, obvykle ve formě tepla. Produkty reakce proto mají vyšší chemickou energii než reaktanty, které do reakce vstoupily.
Co ovlivňuje chemické reakce
Rychlost chemické reakce je ovlivněna řadou různých faktorů, včetně koncentrace látek účastnících se reakce, velikosti povrchu, teploty a používáním katalyzátorů. Obecně vzato zvýšení koncentrace reaktantů v roztoku, zvýšení povrchu u reakcí v pevné fázi a zvýšení teploty reakčního systému zvýší rychlost reakce.Reakční rychlost je definována jako množství chemické sloučeniny, které vznikne nebo zanikne (v molech nebo jednotkách hmotnosti) v jednotce objemu za jednotku času. Znalost této veličiny je velmi důležitá v mnoha oblastech chemie, např. v chemickém inženýrství.U zvratných reakcí je dosaženo rovnováhy v okamžiku, kdy jsou rychlosti obou reakcí (přímé a zpětné) shodné a koncentrace látek v systému se již dále nemění. Rovnováhu lze ovlivnit teplotou, koncentrací nebo tlakem, posun rovnováhy popisuje Le Chatelierův princip. Reakční rychlost je definována jako množství chemické sloučeniny, které vznikne nebo zanikne (v molech nebo jednotkách hmotnosti) v jednotce objemu za jednotku času. Znalost této veličiny je velmi důležitá v mnoha oblastech chemie, např. v chemickém inženýrství.
Jak ovlivňuje teplota chemické reakce : Reakční rychlost elementárních reakcí a naprosté většiny jednoduchých reakcí se s teplotou zvyšuje. Kvalitativním vyjádřením tohoto vlivu je tzv. van't Hoffovo pravidlo, které říká, že při zvýšení teploty systému o 10 °C se rychlost reakce zvýší 1,5 až 3 krát.
Co se děje při chemické reakci : Látky, které do reakce vstupují, nazýváme reaktanty. Látky, které z reakce vystupují, nazýváme produkty. Při tomto procesu dochází ke změnám v rozmístění elektronové hustoty v molekule, zjednodušeně řečeno, dochází k zániku a vzniku chemických vazeb. Chemické reakce popisujeme pomocí chemických rovnic.
Co se zabývá rychlosti chemických reakcí
Chemická kinetika studuje rychlost chemických reakcí. Analýzou vlivů, které tuto rychlost ovlivňují, podává informace o reakčním mechanismu a přechodném stavu chemické reakce. Exotermická (exotermní) reakce (z řeckého ἔξω exo „venku“ a θερμός thermós „teplý, horký, vyhřívaný“) je chemická reakce, při níž se uvolňuje energie, obvykle ve formě tepla. Produkty reakce proto mají nižší chemickou energii než reaktanty, které do reakce vstoupily.Hlavní jednotka SI: metr za sekundu, m·s−1 , m/s.
Kdo se zabyva rychlosti chemických reakcí : Chemická kinetika studuje rychlosti a mechanismy chemických reakcí. Rychlost reakce je měřítkem, jak rychle vznikají produkty a zanikají reagující látky. Mechanismus reakce je podrobný popis posloupnosti jednotlivých kroků, které se odehrávají na úrovni molekul, vedoucích od reaktantů k produktům.
Antwort Kdo se zabyva rychlosti chemických reakcí? Weitere Antworten – Čím se zabývá reakční kinetika
se zabývá rychlostí chemických reakcí.- katalyzátor reakci urychluje, inhibitor zpomaluje. V některé literatuře je možno se setkat také s pojmy „katalyzátor pozitivní“ (urychluje reakci) a „katalyzátor negativní“ (zpomaluje reakci, tedy inhibitor). Katalyzátor (inhibitor) se při reakci nespotřebovává). vratné a probíhají až do ustálení rovnovážného stavu.Závislost koncentrace výchozích látek na rychlost chemické reakce je charakterizována Guldberg-Waagovým zákonem: Rychlost chemických reakcí je přímo úměrná koncentraci výchozích látek (eduktů). Z tohoto vztahu vyplývá, že chemická reakce probíhá tím rychleji, čím jsou edukty koncentrovanější.
Jak závisí rychlost reakce na teplotě : Při zvýšení teploty o 10 °C se hodnota rychlostní konstanty, a tím i rychlost reakce, zvyšuje zpravidla dvakrát až čtyřikrát.
Kdo se zabyva rychlostí chemických reakcí
Chemická kinetika studuje rychlosti a mechanismy chemických reakcí. Rychlost reakce je měřítkem, jak rychle vznikají produkty a zanikají reagující látky. Mechanismus reakce je podrobný popis posloupnosti jednotlivých kroků, které se odehrávají na úrovni molekul, vedoucích od reaktantů k produktům.
Jak určit rád reakce : Řád reakce je číslo, které určuje, jakým způsobem závisí rychlost na koncentraci. Určujeme řády dílčí vždy vůči jen některým reaktantům a řád celkový, který je součtem všech dílčích řádů vůči jednotlivým reaktantům.
Studiem reakční rychlosti se zabývá chemická kinetika. Aby mohly spolu dvě či více látek reagovat, musí dojít ke srážce jejich molekul. Pravděpodobnost srážky se zvyšuje s rostoucí teplotou, tlakem a koncentrací látek.

Endotermická (endotermní) reakce (z řeckého ἔξω endo „dovnitř“ a θερμός thermós „teplý, horký, vyhřívaný“) je chemická reakce, při níž se energie spotřebovává, obvykle ve formě tepla. Produkty reakce proto mají vyšší chemickou energii než reaktanty, které do reakce vstoupily.
Co ovlivňuje chemické reakce
Rychlost chemické reakce je ovlivněna řadou různých faktorů, včetně koncentrace látek účastnících se reakce, velikosti povrchu, teploty a používáním katalyzátorů. Obecně vzato zvýšení koncentrace reaktantů v roztoku, zvýšení povrchu u reakcí v pevné fázi a zvýšení teploty reakčního systému zvýší rychlost reakce.Reakční rychlost je definována jako množství chemické sloučeniny, které vznikne nebo zanikne (v molech nebo jednotkách hmotnosti) v jednotce objemu za jednotku času. Znalost této veličiny je velmi důležitá v mnoha oblastech chemie, např. v chemickém inženýrství.U zvratných reakcí je dosaženo rovnováhy v okamžiku, kdy jsou rychlosti obou reakcí (přímé a zpětné) shodné a koncentrace látek v systému se již dále nemění. Rovnováhu lze ovlivnit teplotou, koncentrací nebo tlakem, posun rovnováhy popisuje Le Chatelierův princip.
Reakční rychlost je definována jako množství chemické sloučeniny, které vznikne nebo zanikne (v molech nebo jednotkách hmotnosti) v jednotce objemu za jednotku času. Znalost této veličiny je velmi důležitá v mnoha oblastech chemie, např. v chemickém inženýrství.
Jak ovlivňuje teplota chemické reakce : Reakční rychlost elementárních reakcí a naprosté většiny jednoduchých reakcí se s teplotou zvyšuje. Kvalitativním vyjádřením tohoto vlivu je tzv. van't Hoffovo pravidlo, které říká, že při zvýšení teploty systému o 10 °C se rychlost reakce zvýší 1,5 až 3 krát.
Co se děje při chemické reakci : Látky, které do reakce vstupují, nazýváme reaktanty. Látky, které z reakce vystupují, nazýváme produkty. Při tomto procesu dochází ke změnám v rozmístění elektronové hustoty v molekule, zjednodušeně řečeno, dochází k zániku a vzniku chemických vazeb. Chemické reakce popisujeme pomocí chemických rovnic.
Co se zabývá rychlosti chemických reakcí
Chemická kinetika studuje rychlost chemických reakcí. Analýzou vlivů, které tuto rychlost ovlivňují, podává informace o reakčním mechanismu a přechodném stavu chemické reakce.

Exotermická (exotermní) reakce (z řeckého ἔξω exo „venku“ a θερμός thermós „teplý, horký, vyhřívaný“) je chemická reakce, při níž se uvolňuje energie, obvykle ve formě tepla. Produkty reakce proto mají nižší chemickou energii než reaktanty, které do reakce vstoupily.Hlavní jednotka SI: metr za sekundu, m·s−1 , m/s.
Kdo se zabyva rychlosti chemických reakcí : Chemická kinetika studuje rychlosti a mechanismy chemických reakcí. Rychlost reakce je měřítkem, jak rychle vznikají produkty a zanikají reagující látky. Mechanismus reakce je podrobný popis posloupnosti jednotlivých kroků, které se odehrávají na úrovni molekul, vedoucích od reaktantů k produktům.