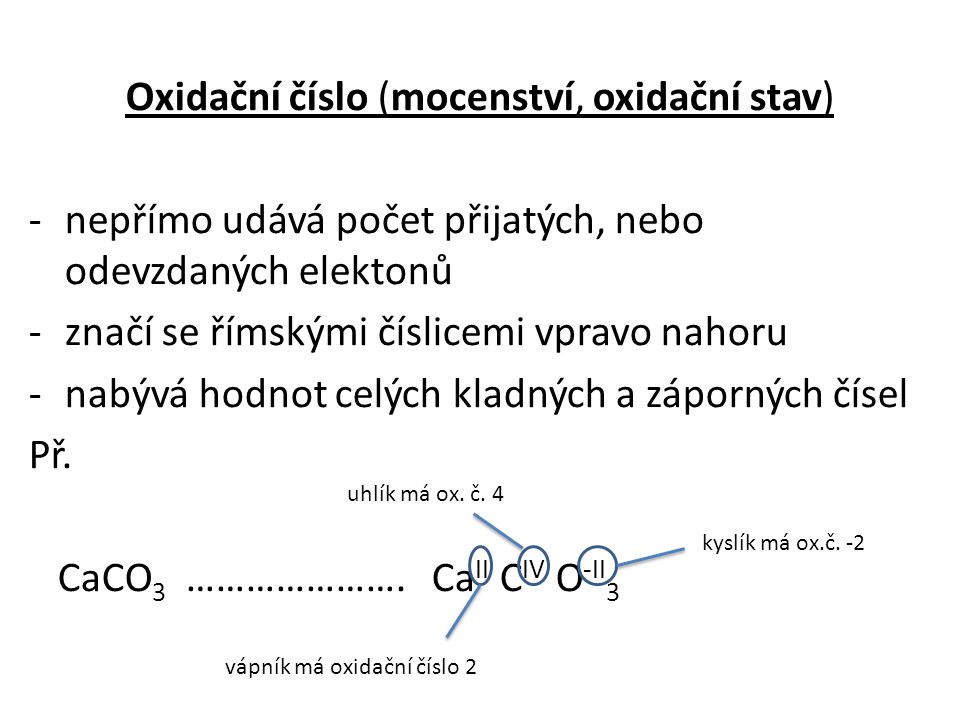
Oxidační číslo píšeme římskou číslicí, znaménko „plus/mínus“ píšeme před číslici (např. +II; –IV), kladné oxidační stavy se někdy píšou i bez znaménka plus. Arabské číslice používáme pro vyjádření náboje jednoatomových nebo víceatomových iontů.charakteristické koncovky podle oxidačního čísla prvku tzn. stačí si pamatovat jako básničku ný, natý, itý, ičitý, ičný/ečný, ový, istý, ičelý a přiřadit koncovce ný číslo 1, koncovce natý číslo 2 atd.Oxidační číslo iontu atomu odpovídá jeho iontovému náboji. V kationtu Cu2+ má měď oxidační číslo II+, v aniontu Cl− má chlor oxidační číslo I−. Většina prvků se může vyskytnout v několika oxidačních číslech.
Proč má kyslík oxidační číslo 2 : Proč má prvek kyslík ve sloučeninách oxidační číslo –II Kyslíku chybí 2 elektrony k zaplnění vrstvy. Po přijetí 2 elektronů bude mít 8p+ a 10e-. Náboj částice je -2,tedy oxidační číslo je –II.
Jak poznat oxidační a redukční činidlo
oxidační činidlo – je taková látka, která má schopnost přijímat elektrony (redukovat se), jiné látky oxiduje.
redukční činidlo – látka, která může elektrony poskytovat (oxidovat se), jiné látky redukuje.
Jaké oxidační číslo má kyslík : Oxidační číslo kyslíku je −II, protože kyslík je elektronegativnější než síra, má větší schopnost přitahovat vazebné elektronové páry.
Kladné hodnoty oxidačního čísla se pohybují v rozmezí od I+ do VIII+. Záporné hodnoty se pohybují v rozmezí od I- až do IV-. U kladných oxidačních čísel se znaménko psát ani číst nemusí, ale my jej pro větší přehlednost píšeme. U záporných oxidačních čísel se znaménko bezpodmínečně píše i čte. Kdykoliv se nějaká částice (atom, molekula, ion) oxiduje, odevzdává elektrony a zvyšuje své oxidační číslo. Naopak při redukci částice elektrony přijímá a její oxidační číslo se snižuje. Oxidace a redukce tedy probíhá vždy současně, zatímco jedna látka elektrony odevzdává, druhá je přijímá.
Jak se značí kyslík
Kyslík (chemická značka O, latinsky oxygenium) je plynný chemický prvek, tvořící druhou hlavní složku zemské atmosféry.Redukční činidlo je látka, která se snadno oxiduje a na jiné látky působí redukčně. Známá redukční činidla jsou např. siřičitanový anion a alkalické kovy, za vysoké teploty rovněž vodík, uhlík nebo oxid uhelnatý.Oxidační činidlo je látka, která při oxidačně-redukční reakci vyvolává oxidaci jiné látky a sama se při tom redukuje. Redukční činidlo je látka, která při oxidačně-redukční reakci vyvolává redukci jiné látky a sama se při tom oxiduje. Oxidační číslo píšeme římskou číslicí, znaménko „plus/mínus“ píšeme před číslici (např. +II; –IV), kladné oxidační stavy se někdy píšou i bez znaménka plus. Arabské číslice používáme pro vyjádření náboje jednoatomových nebo víceatomových iontů.
Jak poznat redoxní rovnice : Redoxní reakce poznáme podle toho, že při nich dochází ke změně oxidačních čísel reaktantů. Redoxní reakce můžeme rozdělit na dvě dílčí poloreakce příslušející oxidaci a redukci. Při vyčíslování redoxních rovnic musíme dbát nejen na bilanci prvků, ale i na bilanci náboje, k tomu nám může pomoci metoda poloreakcí.
Co je 02 : Kyslík má v periodické soustavě číslo 8. Má tedy 8 protonů a 8 elektronů. Vyskytuje se v přírodě jako volný (ve formě prvku) ve vzduchu, ale i jako vázaný v různých sloučeninách s jinými prvky. Například ve vodě, oxidech, kyslíkatých kyselinách, hydroxidech a také v řadě organických sloučenin.
Co je O³
Ozón je bezbarvý, ve vyšších koncentracích namodralý plyn, těžší než vzduch. Je tvořen třemi atomy kyslíku (O3). Jiný název je také “aktivní kyslík“. Vzhledem k nahromaděné energii je molekula ozónu velmi nestabilní a po krátké době se zpět samovolně rozpadá na kyslík (O2). Mezi nejsilnější oxidační činidla patří prvky z pravé horní části periodické tabulky (například: fluor, kyslík, chlor) a některé sloučeniny (anorg. kyseliny, manganistany, peroxidy) a některé druhy molekul prvků (ozon).Redukční činidlo je látka, která se snadno oxiduje a na jiné látky působí redukčně. Známá redukční činidla jsou např. siřičitanový anion a alkalické kovy, za vysoké teploty rovněž vodík, uhlík nebo oxid uhelnatý.
Co je to redoxní rovnice : Chemická rovnice popisuje průběh chemického děje, při němž ze vstupních látek (reaktantů) vznikají nové látky (produkty). Pokud při chemické reakci dochází ke změně oxidačních čísel některých (nebo i všech) atomů, označujeme takovou reakci jako oxidačně-redukční (zkráceně redoxní) reakci.
Antwort Jak se značí oxidační číslo? Weitere Antworten – Jak se zjišťuje oxidační číslo
Oxidační číslo píšeme římskou číslicí, znaménko „plus/mínus“ píšeme před číslici (např. +II; –IV), kladné oxidační stavy se někdy píšou i bez znaménka plus. Arabské číslice používáme pro vyjádření náboje jednoatomových nebo víceatomových iontů.charakteristické koncovky podle oxidačního čísla prvku tzn. stačí si pamatovat jako básničku ný, natý, itý, ičitý, ičný/ečný, ový, istý, ičelý a přiřadit koncovce ný číslo 1, koncovce natý číslo 2 atd.Oxidační číslo iontu atomu odpovídá jeho iontovému náboji. V kationtu Cu2+ má měď oxidační číslo II+, v aniontu Cl− má chlor oxidační číslo I−. Většina prvků se může vyskytnout v několika oxidačních číslech.
Proč má kyslík oxidační číslo 2 : Proč má prvek kyslík ve sloučeninách oxidační číslo –II Kyslíku chybí 2 elektrony k zaplnění vrstvy. Po přijetí 2 elektronů bude mít 8p+ a 10e-. Náboj částice je -2,tedy oxidační číslo je –II.
Jak poznat oxidační a redukční činidlo
Jaké oxidační číslo má kyslík : Oxidační číslo kyslíku je −II, protože kyslík je elektronegativnější než síra, má větší schopnost přitahovat vazebné elektronové páry.
Kladné hodnoty oxidačního čísla se pohybují v rozmezí od I+ do VIII+. Záporné hodnoty se pohybují v rozmezí od I- až do IV-. U kladných oxidačních čísel se znaménko psát ani číst nemusí, ale my jej pro větší přehlednost píšeme. U záporných oxidačních čísel se znaménko bezpodmínečně píše i čte.

Kdykoliv se nějaká částice (atom, molekula, ion) oxiduje, odevzdává elektrony a zvyšuje své oxidační číslo. Naopak při redukci částice elektrony přijímá a její oxidační číslo se snižuje. Oxidace a redukce tedy probíhá vždy současně, zatímco jedna látka elektrony odevzdává, druhá je přijímá.
Jak se značí kyslík
Kyslík (chemická značka O, latinsky oxygenium) je plynný chemický prvek, tvořící druhou hlavní složku zemské atmosféry.Redukční činidlo je látka, která se snadno oxiduje a na jiné látky působí redukčně. Známá redukční činidla jsou např. siřičitanový anion a alkalické kovy, za vysoké teploty rovněž vodík, uhlík nebo oxid uhelnatý.Oxidační činidlo je látka, která při oxidačně-redukční reakci vyvolává oxidaci jiné látky a sama se při tom redukuje. Redukční činidlo je látka, která při oxidačně-redukční reakci vyvolává redukci jiné látky a sama se při tom oxiduje.

Oxidační číslo píšeme římskou číslicí, znaménko „plus/mínus“ píšeme před číslici (např. +II; –IV), kladné oxidační stavy se někdy píšou i bez znaménka plus. Arabské číslice používáme pro vyjádření náboje jednoatomových nebo víceatomových iontů.
Jak poznat redoxní rovnice : Redoxní reakce poznáme podle toho, že při nich dochází ke změně oxidačních čísel reaktantů. Redoxní reakce můžeme rozdělit na dvě dílčí poloreakce příslušející oxidaci a redukci. Při vyčíslování redoxních rovnic musíme dbát nejen na bilanci prvků, ale i na bilanci náboje, k tomu nám může pomoci metoda poloreakcí.
Co je 02 : Kyslík má v periodické soustavě číslo 8. Má tedy 8 protonů a 8 elektronů. Vyskytuje se v přírodě jako volný (ve formě prvku) ve vzduchu, ale i jako vázaný v různých sloučeninách s jinými prvky. Například ve vodě, oxidech, kyslíkatých kyselinách, hydroxidech a také v řadě organických sloučenin.
Co je O³
Ozón je bezbarvý, ve vyšších koncentracích namodralý plyn, těžší než vzduch. Je tvořen třemi atomy kyslíku (O3). Jiný název je také “aktivní kyslík“. Vzhledem k nahromaděné energii je molekula ozónu velmi nestabilní a po krátké době se zpět samovolně rozpadá na kyslík (O2).
Mezi nejsilnější oxidační činidla patří prvky z pravé horní části periodické tabulky (například: fluor, kyslík, chlor) a některé sloučeniny (anorg. kyseliny, manganistany, peroxidy) a některé druhy molekul prvků (ozon).Redukční činidlo je látka, která se snadno oxiduje a na jiné látky působí redukčně. Známá redukční činidla jsou např. siřičitanový anion a alkalické kovy, za vysoké teploty rovněž vodík, uhlík nebo oxid uhelnatý.
Co je to redoxní rovnice : Chemická rovnice popisuje průběh chemického děje, při němž ze vstupních látek (reaktantů) vznikají nové látky (produkty). Pokud při chemické reakci dochází ke změně oxidačních čísel některých (nebo i všech) atomů, označujeme takovou reakci jako oxidačně-redukční (zkráceně redoxní) reakci.