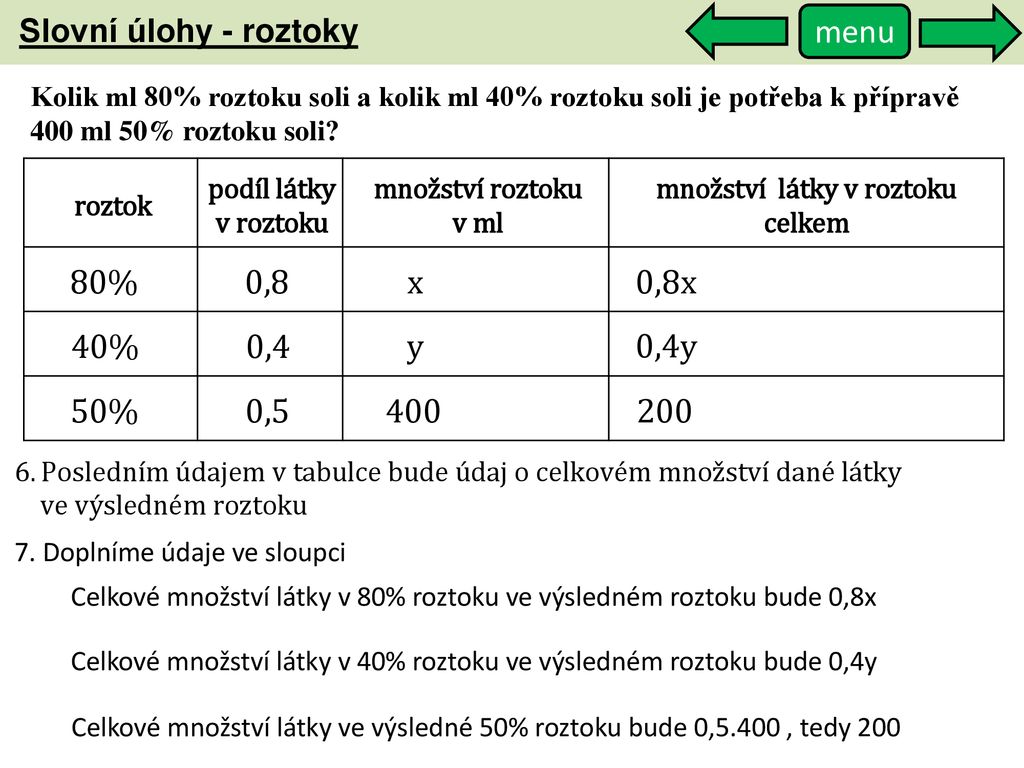
c = n/V. Obvykle se látková koncentrace vyjadřuje v jednotkách mol/l (mol dm–3) a můžeme se setkat se starším značením 1 mol/l = 1 M. Vypočítejte látkovou koncentraci NaCl ve 200 ml roztoku, na jehož přípravu jsme použili 10 g NaCl (M = 58,44 g/mol).1) Procentní koncentrace
Ukazuje, kolik dílů rozpuštěné látky se nachází v 100 dílech roztoku. Příklad 1. 5 % roztok NaCl znamená, že v 100 dílech (g, kg, t, …,) roztoku je 5 dílů NaCl a 95 dílů vody.Příklad: Máme připravit 1 % (w/v) NaCl. Použijeme tedy 1 g NaCl, který rozpustíme v daném roztokku (případně ve vodě) a doplníme do výsledného objemu 100 ml. Výpočet molární koncentrace z procentuální koncentrace: Při tomto výpočtu je třeba znát údaj o molární hmotnosti dané látky (MW) a její hustotě.
Co znamená 1M roztok : Pokud I litr roztoku obsahuje 1 mol rozpuštěné látky, c = 1 mol. dm-3, roztok označíme jako tzv. jednomolární roztok (1M).
Co znamená 5% roztok
Objemová a hmotnostní procenta – udávají počet dílů rozpuštěné látky ve 100 dílech roztoku (například 5% roztok chloridu sodného obsahuje 5 g NaCl a 95 g H2O)
Jak vypočítat faktor roztoku : Faktor roztoku je číslo, udávající kolika cm3 roztoku o přesné látkové koncentraci odpovídá 1 cm3 roztokuo přibližné látkové koncentraci. Vynásobíme-li tedy faktorem objem roztoku o přibližné látkové koncentraci, vypočítáme k tomuto množství odpovídající objem roztoku o přesné látkové koncentraci.
Návod pro použití výpočtu míchání roztoků:
Systém počítá pouze veličiny vztažené k objemu (hmotnostní koncentrace, objemová koncentrace či molární koncentrace). Vzorce pro výpočet těchto veličin jsou vždy stejné: V = V1 + V2, c = (c1*V1 + c2*V2) / V. Na přípravu 500 ml 10 % HCl je potřeba: 124,6 ml 35 %-ního roztoku HCl a 366,1 ml vody.
Co znamená 2M roztok
2M znamená, že roztok je dvoumolární, tedy s koncentrací 2 mol/dm3. Je možné použít i násobných předpon, např. mM pak znamená milimolární (mmol/dm3), μM znamená mikromolární (μmol/dm3) atd. Tento způsob vyjadřování koncentrace se velmi často používá v analytické chemii.Molární hmotnost vody M(H2O) se bude skládat ze dvou molárních hmotností vodíku M(H) a jedné kyslíku M(O), protože molekula vody obsahuje dva vodíkové atomy a jeden atom kyslíkový. Jeden mol vody váží 18 g.100/80 = 31,25% Page 5 3) 10% roztok obsahuje 10 g rozpuštěné látky a 90 g rozpouštědla. Na přípravu 500 ml 10 % HCl je potřeba: 124,6 ml 35 %-ního roztoku HCl a 366,1 ml vody.
Jak vypočítat faktor : Faktor roztoku je číslo, udávající kolika cm3 roztoku o přesné látkové koncentraci odpovídá 1 cm3 roztokuo přibližné látkové koncentraci. Vynásobíme-li tedy faktorem objem roztoku o přibližné látkové koncentraci, vypočítáme k tomuto množství odpovídající objem roztoku o přesné látkové koncentraci.
Jak připravit 20% roztok : Příklad: Příprava 20 % (w/w) NaCl. 20 g NaCl je rozpuštěno ve 100 g výsledného roztoku. Objemová procenta (v/v) jsou definována jako počet mililitrů látky na 100 ml výsledného roztoku.
Kolik je 1 mol litrů
Z definice vyplývá, že 1 mol plynné látky má objem 22.41 dm3 (nebo litrů). n = Molární hmotnost vypočítáme z údajů v periodické soustavě prvků, s její pomocí je výpočet poměrně jednoduchý. Stačí sečíst všechny atomové hmotnosti prvků dané sloučeniny. Pokud je jeden atom ve sloučenině vícekrát (např. v H2O jsou dva atomy vodíku a jeden atom kyslíku), pak jej také do součtu přidáme vícekrát.Odměrný roztok je činidlo, které se při titraci přidává ke stanovované látce (roztok, kterým titrujeme a jehož spotřebu měříme). Je látka definovaného chemického složení, chemicky čistá (čistota se během skladování nesmí měnit – např. nesmí reagovat s CO2, podléhat oxidaci vzdušným kyslíkem….)
Co je to jeden mol : Jednotkou látkového množství je 1 mol. mol Jeden mol je takové látkové množství, které obsahuje stejný počet částic, jako je počet atomů uhlíku v 12 g nuklidu 12C. Částice musí být vždy specifikována, nejčastěji v závorce za symbolem látkového množství látky, a může jí být molekula, atom, ion, elektron apod.
Antwort Jak se počítají Roztoky v chemii? Weitere Antworten – Jak vypočítat roztok
c = n/V. Obvykle se látková koncentrace vyjadřuje v jednotkách mol/l (mol dm–3) a můžeme se setkat se starším značením 1 mol/l = 1 M. Vypočítejte látkovou koncentraci NaCl ve 200 ml roztoku, na jehož přípravu jsme použili 10 g NaCl (M = 58,44 g/mol).1) Procentní koncentrace
Ukazuje, kolik dílů rozpuštěné látky se nachází v 100 dílech roztoku. Příklad 1. 5 % roztok NaCl znamená, že v 100 dílech (g, kg, t, …,) roztoku je 5 dílů NaCl a 95 dílů vody.Příklad: Máme připravit 1 % (w/v) NaCl. Použijeme tedy 1 g NaCl, který rozpustíme v daném roztokku (případně ve vodě) a doplníme do výsledného objemu 100 ml. Výpočet molární koncentrace z procentuální koncentrace: Při tomto výpočtu je třeba znát údaj o molární hmotnosti dané látky (MW) a její hustotě.

Co znamená 1M roztok : Pokud I litr roztoku obsahuje 1 mol rozpuštěné látky, c = 1 mol. dm-3, roztok označíme jako tzv. jednomolární roztok (1M).
Co znamená 5% roztok
Objemová a hmotnostní procenta – udávají počet dílů rozpuštěné látky ve 100 dílech roztoku (například 5% roztok chloridu sodného obsahuje 5 g NaCl a 95 g H2O)
Jak vypočítat faktor roztoku : Faktor roztoku je číslo, udávající kolika cm3 roztoku o přesné látkové koncentraci odpovídá 1 cm3 roztokuo přibližné látkové koncentraci. Vynásobíme-li tedy faktorem objem roztoku o přibližné látkové koncentraci, vypočítáme k tomuto množství odpovídající objem roztoku o přesné látkové koncentraci.
Návod pro použití výpočtu míchání roztoků:
Systém počítá pouze veličiny vztažené k objemu (hmotnostní koncentrace, objemová koncentrace či molární koncentrace). Vzorce pro výpočet těchto veličin jsou vždy stejné: V = V1 + V2, c = (c1*V1 + c2*V2) / V.
Na přípravu 500 ml 10 % HCl je potřeba: 124,6 ml 35 %-ního roztoku HCl a 366,1 ml vody.
Co znamená 2M roztok
2M znamená, že roztok je dvoumolární, tedy s koncentrací 2 mol/dm3. Je možné použít i násobných předpon, např. mM pak znamená milimolární (mmol/dm3), μM znamená mikromolární (μmol/dm3) atd. Tento způsob vyjadřování koncentrace se velmi často používá v analytické chemii.Molární hmotnost vody M(H2O) se bude skládat ze dvou molárních hmotností vodíku M(H) a jedné kyslíku M(O), protože molekula vody obsahuje dva vodíkové atomy a jeden atom kyslíkový. Jeden mol vody váží 18 g.100/80 = 31,25% Page 5 3) 10% roztok obsahuje 10 g rozpuštěné látky a 90 g rozpouštědla.

Na přípravu 500 ml 10 % HCl je potřeba: 124,6 ml 35 %-ního roztoku HCl a 366,1 ml vody.
Jak vypočítat faktor : Faktor roztoku je číslo, udávající kolika cm3 roztoku o přesné látkové koncentraci odpovídá 1 cm3 roztokuo přibližné látkové koncentraci. Vynásobíme-li tedy faktorem objem roztoku o přibližné látkové koncentraci, vypočítáme k tomuto množství odpovídající objem roztoku o přesné látkové koncentraci.
Jak připravit 20% roztok : Příklad: Příprava 20 % (w/w) NaCl. 20 g NaCl je rozpuštěno ve 100 g výsledného roztoku. Objemová procenta (v/v) jsou definována jako počet mililitrů látky na 100 ml výsledného roztoku.
Kolik je 1 mol litrů
Z definice vyplývá, že 1 mol plynné látky má objem 22.41 dm3 (nebo litrů). n =
Molární hmotnost vypočítáme z údajů v periodické soustavě prvků, s její pomocí je výpočet poměrně jednoduchý. Stačí sečíst všechny atomové hmotnosti prvků dané sloučeniny. Pokud je jeden atom ve sloučenině vícekrát (např. v H2O jsou dva atomy vodíku a jeden atom kyslíku), pak jej také do součtu přidáme vícekrát.Odměrný roztok je činidlo, které se při titraci přidává ke stanovované látce (roztok, kterým titrujeme a jehož spotřebu měříme). Je látka definovaného chemického složení, chemicky čistá (čistota se během skladování nesmí měnit – např. nesmí reagovat s CO2, podléhat oxidaci vzdušným kyslíkem….)
Co je to jeden mol : Jednotkou látkového množství je 1 mol. mol Jeden mol je takové látkové množství, které obsahuje stejný počet částic, jako je počet atomů uhlíku v 12 g nuklidu 12C. Částice musí být vždy specifikována, nejčastěji v závorce za symbolem látkového množství látky, a může jí být molekula, atom, ion, elektron apod.