Chemická vazba. Zaplněná valenční slupka má osm elektronů. Tento stav se nazývá elektronový oktet. V periodické tabulce prvků objevené D. I.Valenční elektrony jsou elektrony, které atomu přebývají nad konfiguraci nejbližšího předchozího vzácného plynu. Například atom kyslíku má 6 valenčních elektronů, neboť je prvkem VI. A podskupiny a přebývá mu tedy 6 elektronů nad konfiguraci předchozího vzácného plynu (helia).Počet elektronů ve slupce nejdále od jádra určuje reaktivitu atomu neboli sklon k vytváření vazeb s ostatními atomy. Tato slupka nejdále od jádra se nazývá valenční slupka a elektrony, které se v ní nacházejí, se nazývají valenční elektrony.
Co to jsou elektronové vrstvy : Skupina všech orbitalů v atomu, které mají stejné hlavní kvantové číslo (energii mít stejnou nemusejí), se nazývá elektronová vrstva. O elektronech v atomu, které mají stejnou energii (mají stejné hlavní i vedlejší kvantové číslo), říkáme, že jsou na stejné energetické hladině.
Jak se počítají elektrony
Společně tyto částice nazýváme nukleony. Nejjednodušším atomem je atom vodíku, jehož jádro je tvořeno protonem a kolem jádra obíhá jediný elektron. Složitější atomy mají v jádře větší počet protonů a neutronů, počet obíhajících elektronů se rovná počtu protonů v jádře.
Jak se nazývá poslední vrstva elektronů : Nejvzdálenější vrstva v atomovém obalu obsazená elektrony se nazývá valenční. Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se daný chemický prvek v periodické soustavě nachází. Jako va- lenční elektrony se nazývají elektrony, které se nachází na této valenční vrstvě.
Nejvzdálenější vrstva v atomovém obalu obsazená elektrony se nazývá valenční. Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se daný chemický prvek v periodické soustavě nachází. Valenční elektrony jsou elektrony, které atomu přebývají nad konfiguraci nejbližšího předchozího vzácného plynu. Například atom kyslíku má 6 valenčních elektronů, neboť je prvkem VI. A podskupiny a přebývá mu tedy 6 elektronů nad konfiguraci předchozího vzácného plynu (helia).
Jak se jmenuje poslední vrstva elektronů
Elektrony v poslední, neúplně zaplněné vrstvě se nazývají valenční. Jsou to elektrony s nejvyšší energií, k jádru jsou nejvolněji poutány a zodpovídají za chemické vlastnosti prvků. V jednotlivých vrstvách jsou elektrony lokalizovány v tzv. orbitalech.Nejvzdálenější vrstva v atomovém obalu obsazená elektrony se nazývá valenční. Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se daný chemický prvek v periodické soustavě nachází.Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se atom nachází v periodické tabulce objevené D. I. Mendělejevem. V tabulce jsou uvedeny prvky periodické tabulky podle jejich pořadí, které zároveň udává počet elektronů v jejich elektronovém obalu. Počet protonů odpovídá počtu elektronů – elektroneutralita atomu. Protonové číslo Udává počet protonů v jádře atomu a počet elektronů v obalu elektroneutrálního atomu. Shoduje se s pořadovým číslem prvku v periodické soustavě prvků.
Jak se nazývá poslední vrstva atomu : Nejvzdálenější vrstva v atomovém obalu obsazená elektrony se nazývá valenční. Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se daný chemický prvek v periodické soustavě nachází. Jako va- lenční elektrony se nazývají elektrony, které se nachází na této valenční vrstvě.
Kolik má sodík valenčních elektronů : Atom sodíku obsahuje jeden valenční elektron.
Jak se určuje počet elektronů
protonové (atomové) číslo Z – je rovno počtu protonů v jádře, udává také počet elektronů obíhajících kolem jádra. Síra je šestnáctým prvkem periodické soustavy. Jelikož se nachází v VI. A skupině, patří mezi tzv. "chalkogeny" (česky "rudotvorné") a má 6 valenčních elektronů.Orbital atomový
vymezují jakousi existenční oblast elektronu v atomu. Této oblasti nejpravděpodobnějšího výskytu elektronu se říká atomový orbital. Atomové orbitaly se označují symbolem obsahujícím hlavní kvantové číslo n a písmeno, které odpovídá hodnotě vedlejšího kvantového čísla l.
Co je menší než elektron : Podle standardního modelu částicové fyziky je mion (z řeckého μείον = 'minus'; anglicky muon) nestabilní elementární částice se záporným elementárním elektrickým nábojem a spinem 1/2.
Antwort Jak se nazývají elektrony ve valenční vrstvě? Weitere Antworten – Kolik elektronů je ve valenční vrstvě
Chemická vazba. Zaplněná valenční slupka má osm elektronů. Tento stav se nazývá elektronový oktet. V periodické tabulce prvků objevené D. I.Valenční elektrony jsou elektrony, které atomu přebývají nad konfiguraci nejbližšího předchozího vzácného plynu. Například atom kyslíku má 6 valenčních elektronů, neboť je prvkem VI. A podskupiny a přebývá mu tedy 6 elektronů nad konfiguraci předchozího vzácného plynu (helia).Počet elektronů ve slupce nejdále od jádra určuje reaktivitu atomu neboli sklon k vytváření vazeb s ostatními atomy. Tato slupka nejdále od jádra se nazývá valenční slupka a elektrony, které se v ní nacházejí, se nazývají valenční elektrony.
Co to jsou elektronové vrstvy : Skupina všech orbitalů v atomu, které mají stejné hlavní kvantové číslo (energii mít stejnou nemusejí), se nazývá elektronová vrstva. O elektronech v atomu, které mají stejnou energii (mají stejné hlavní i vedlejší kvantové číslo), říkáme, že jsou na stejné energetické hladině.
Jak se počítají elektrony
Společně tyto částice nazýváme nukleony. Nejjednodušším atomem je atom vodíku, jehož jádro je tvořeno protonem a kolem jádra obíhá jediný elektron. Složitější atomy mají v jádře větší počet protonů a neutronů, počet obíhajících elektronů se rovná počtu protonů v jádře.
Jak se nazývá poslední vrstva elektronů : Nejvzdálenější vrstva v atomovém obalu obsazená elektrony se nazývá valenční. Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se daný chemický prvek v periodické soustavě nachází. Jako va- lenční elektrony se nazývají elektrony, které se nachází na této valenční vrstvě.
Nejvzdálenější vrstva v atomovém obalu obsazená elektrony se nazývá valenční. Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se daný chemický prvek v periodické soustavě nachází.
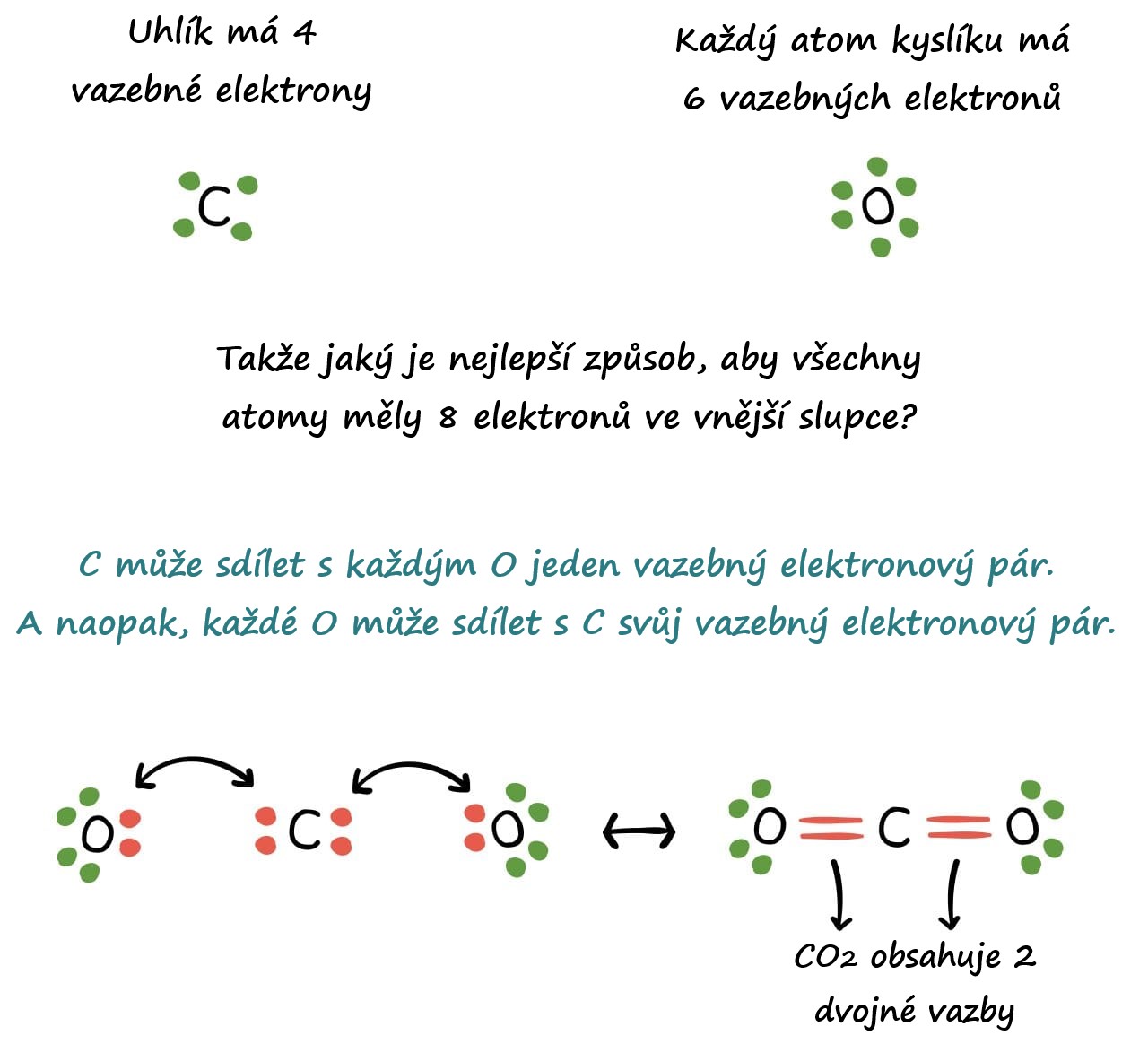
Valenční elektrony jsou elektrony, které atomu přebývají nad konfiguraci nejbližšího předchozího vzácného plynu. Například atom kyslíku má 6 valenčních elektronů, neboť je prvkem VI. A podskupiny a přebývá mu tedy 6 elektronů nad konfiguraci předchozího vzácného plynu (helia).
Jak se jmenuje poslední vrstva elektronů
Elektrony v poslední, neúplně zaplněné vrstvě se nazývají valenční. Jsou to elektrony s nejvyšší energií, k jádru jsou nejvolněji poutány a zodpovídají za chemické vlastnosti prvků. V jednotlivých vrstvách jsou elektrony lokalizovány v tzv. orbitalech.Nejvzdálenější vrstva v atomovém obalu obsazená elektrony se nazývá valenční. Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se daný chemický prvek v periodické soustavě nachází.Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se atom nachází v periodické tabulce objevené D. I. Mendělejevem. V tabulce jsou uvedeny prvky periodické tabulky podle jejich pořadí, které zároveň udává počet elektronů v jejich elektronovém obalu.

Počet protonů odpovídá počtu elektronů – elektroneutralita atomu. Protonové číslo Udává počet protonů v jádře atomu a počet elektronů v obalu elektroneutrálního atomu. Shoduje se s pořadovým číslem prvku v periodické soustavě prvků.
Jak se nazývá poslední vrstva atomu : Nejvzdálenější vrstva v atomovém obalu obsazená elektrony se nazývá valenční. Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se daný chemický prvek v periodické soustavě nachází. Jako va- lenční elektrony se nazývají elektrony, které se nachází na této valenční vrstvě.
Kolik má sodík valenčních elektronů : Atom sodíku obsahuje jeden valenční elektron.
Jak se určuje počet elektronů
protonové (atomové) číslo Z – je rovno počtu protonů v jádře, udává také počet elektronů obíhajících kolem jádra.

Síra je šestnáctým prvkem periodické soustavy. Jelikož se nachází v VI. A skupině, patří mezi tzv. "chalkogeny" (česky "rudotvorné") a má 6 valenčních elektronů.Orbital atomový
vymezují jakousi existenční oblast elektronu v atomu. Této oblasti nejpravděpodobnějšího výskytu elektronu se říká atomový orbital. Atomové orbitaly se označují symbolem obsahujícím hlavní kvantové číslo n a písmeno, které odpovídá hodnotě vedlejšího kvantového čísla l.
Co je menší než elektron : Podle standardního modelu částicové fyziky je mion (z řeckého μείον = 'minus'; anglicky muon) nestabilní elementární částice se záporným elementárním elektrickým nábojem a spinem 1/2.