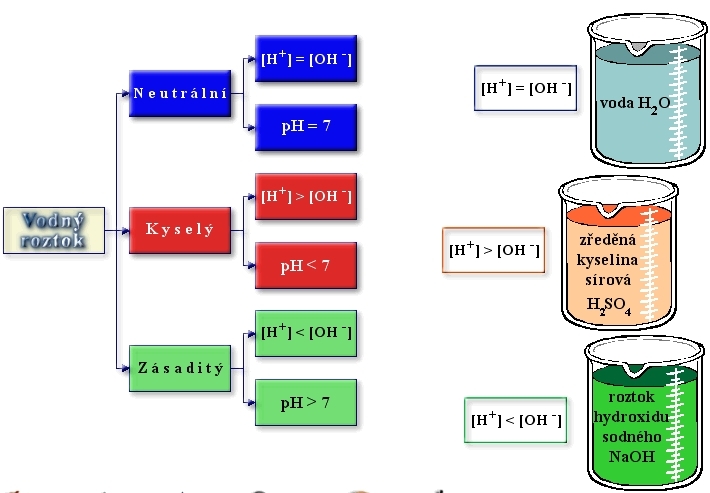
roztok pevné látky a kapaliny (cukr rozpuštěný ve vodě, sůl rozpuštěná ve vodě) roztok dvou kapalin (ethanol rozpuštěný ve vodě – alkoholické nápoje) roztok plynu a kapaliny (oxid uhličitý ve vodě – šumivé nápoje) roztok nejméně dvou plynů (vzduch)Roztok může být kapalný, pevný i plynný. Například cukr rozpuštěný ve vodě, sůl rozpuštěná ve vodě nebo vodní pára ve vzduchu. Podle množství rozpuštěné látky v roztoku hovoříme o nenasyceném, nasyceném či přesyceném roztoku. V nenasyceném roztoku dochází k úplnému rozpuštění rozpouštěné látky.5 % roztok NaCl znamená, že v 100 dílech (g, kg, t, …,) roztoku je 5 dílů NaCl a 95 dílů vody.
Jak jinak říkáme roztoku : Co je potřeba si zapamatovat. Směs/roztok s jednotným složením nazýváme homogenní směs/roztok neboli stejnorodá směs/roztok. Směs s nejednotným složením nazýváme heterogenní směs. Chemická látka, která tvoří většinu roztoku, se nazývá rozpouštědlo, ostatním složkám říkáme rozpuštěná látka.
Jak vyrobit 10% roztok
Hustota vody při 20 °C je 1 g/ml, což znamená, že budeme potřebovat odměřit 180 ml vody k přípravě zadaného roztoku. Vypočtené množství 21,5 g smícháme se 180 ml vody. Vytvoří se roztok NaCl a na dně zůstane nerozpuštěný písek. Tuto směs zfiltrujeme a získáme tak čistý 10% roztok chloridu sodného.
Jak se značí roztok : Hmotnost roztoku se značí m ⊙ , a vypočítá se jako součet hmotnosti rozpuštěné látky A (např. NaCl – chlorid sodný, kuchyňská sůl) a hmotnosti rozpouštědla (rozpouštědlo může být např. voda). Hmotnostní zlomek je bezrozměrná veličina (je bez jednotky), a nabývá hodnot od 0 do 1.
SMĚSI.
Směs.
Typy směsí
Stejnorodé (roztoky) – částečky.
Různorodé – jednotlivé složky odlišíme.
Koloidní – částečky nerozlišíme okem nebo.
Stejnorodé směsi – roztoky.
Koloidní směsi.
Směsi rozdělujeme podle velikosti částeček jednotlivých složek. Dělíme je na směsi stejnorodé, které nazýváme roztoky, směsi koloidní a různorodé. Roztok je homogenní směs jedné nebo více látek rozpuštěná v jiné látce (rozpouštědle).
Co je 10% roztok
100/80 = 31,25% Page 5 3) 10% roztok obsahuje 10 g rozpuštěné látky a 90 g rozpouštědla.Příklad: Máme připravit 1 % (w/v) NaCl. Použijeme tedy 1 g NaCl, který rozpustíme v daném roztokku (případně ve vodě) a doplníme do výsledného objemu 100 ml. Výpočet molární koncentrace z procentuální koncentrace: Při tomto výpočtu je třeba znát údaj o molární hmotnosti dané látky (MW) a její hustotě.Tavenina je roztavená látka nebo směs. V geologii se pod pojmem tavenina většinou popisuje magma. Magma ale obvykle není čistá tavenina, jde povětšinou o směs tavenin. Příklad: Máme připravit 1 % (w/v) NaCl. Použijeme tedy 1 g NaCl, který rozpustíme v daném roztokku (případně ve vodě) a doplníme do výsledného objemu 100 ml. Výpočet molární koncentrace z procentuální koncentrace: Při tomto výpočtu je třeba znát údaj o molární hmotnosti dané látky (MW) a její hustotě.
Jak pripravit 20% roztok : Příklad: Příprava 20 % (w/w) NaCl. 20 g NaCl je rozpuštěno ve 100 g výsledného roztoku. Objemová procenta (v/v) jsou definována jako počet mililitrů látky na 100 ml výsledného roztoku.
Jak se počítá roztok : c = n/V. Obvykle se látková koncentrace vyjadřuje v jednotkách mol/l (mol dm–3) a můžeme se setkat se starším značením 1 mol/l = 1 M. Vypočítejte látkovou koncentraci NaCl ve 200 ml roztoku, na jehož přípravu jsme použili 10 g NaCl (M = 58,44 g/mol).
Co znamená 2M roztok
2M znamená, že roztok je dvoumolární, tedy s koncentrací 2 mol/dm3. Je možné použít i násobných předpon, např. mM pak znamená milimolární (mmol/dm3), μM znamená mikromolární (μmol/dm3) atd. Tento způsob vyjadřování koncentrace se velmi často používá v analytické chemii. Směs se skládá z více chemických látek. Při jejich mísení nedochází ke změnám vazeb. Mohou se však měnit fyzikální vlastnosti: např. voda se solí má nižší teplotu tání než čistá voda.V závislosti na vnějších podmínkách mohou být homogenní směsi:
plynné (například vzduch, propanbutanová směs)
kapalné (například roztok kuchyňské soli ve vodě, ocet, čaj)
pevné (například slitina bronz, sklo).
Jak připravit 20% roztok : Příklad: Příprava 20 % (w/w) NaCl. 20 g NaCl je rozpuštěno ve 100 g výsledného roztoku. Objemová procenta (v/v) jsou definována jako počet mililitrů látky na 100 ml výsledného roztoku.
Antwort Jak se dělí Roztoky? Weitere Antworten – Jak Delime roztoky
roztok pevné látky a kapaliny (cukr rozpuštěný ve vodě, sůl rozpuštěná ve vodě) roztok dvou kapalin (ethanol rozpuštěný ve vodě – alkoholické nápoje) roztok plynu a kapaliny (oxid uhličitý ve vodě – šumivé nápoje) roztok nejméně dvou plynů (vzduch)Roztok může být kapalný, pevný i plynný. Například cukr rozpuštěný ve vodě, sůl rozpuštěná ve vodě nebo vodní pára ve vzduchu. Podle množství rozpuštěné látky v roztoku hovoříme o nenasyceném, nasyceném či přesyceném roztoku. V nenasyceném roztoku dochází k úplnému rozpuštění rozpouštěné látky.5 % roztok NaCl znamená, že v 100 dílech (g, kg, t, …,) roztoku je 5 dílů NaCl a 95 dílů vody.
Jak jinak říkáme roztoku : Co je potřeba si zapamatovat. Směs/roztok s jednotným složením nazýváme homogenní směs/roztok neboli stejnorodá směs/roztok. Směs s nejednotným složením nazýváme heterogenní směs. Chemická látka, která tvoří většinu roztoku, se nazývá rozpouštědlo, ostatním složkám říkáme rozpuštěná látka.
Jak vyrobit 10% roztok
Hustota vody při 20 °C je 1 g/ml, což znamená, že budeme potřebovat odměřit 180 ml vody k přípravě zadaného roztoku. Vypočtené množství 21,5 g smícháme se 180 ml vody. Vytvoří se roztok NaCl a na dně zůstane nerozpuštěný písek. Tuto směs zfiltrujeme a získáme tak čistý 10% roztok chloridu sodného.
Jak se značí roztok : Hmotnost roztoku se značí m ⊙ , a vypočítá se jako součet hmotnosti rozpuštěné látky A (např. NaCl – chlorid sodný, kuchyňská sůl) a hmotnosti rozpouštědla (rozpouštědlo může být např. voda). Hmotnostní zlomek je bezrozměrná veličina (je bez jednotky), a nabývá hodnot od 0 do 1.
Směsi rozdělujeme podle velikosti částeček jednotlivých složek. Dělíme je na směsi stejnorodé, které nazýváme roztoky, směsi koloidní a různorodé. Roztok je homogenní směs jedné nebo více látek rozpuštěná v jiné látce (rozpouštědle).
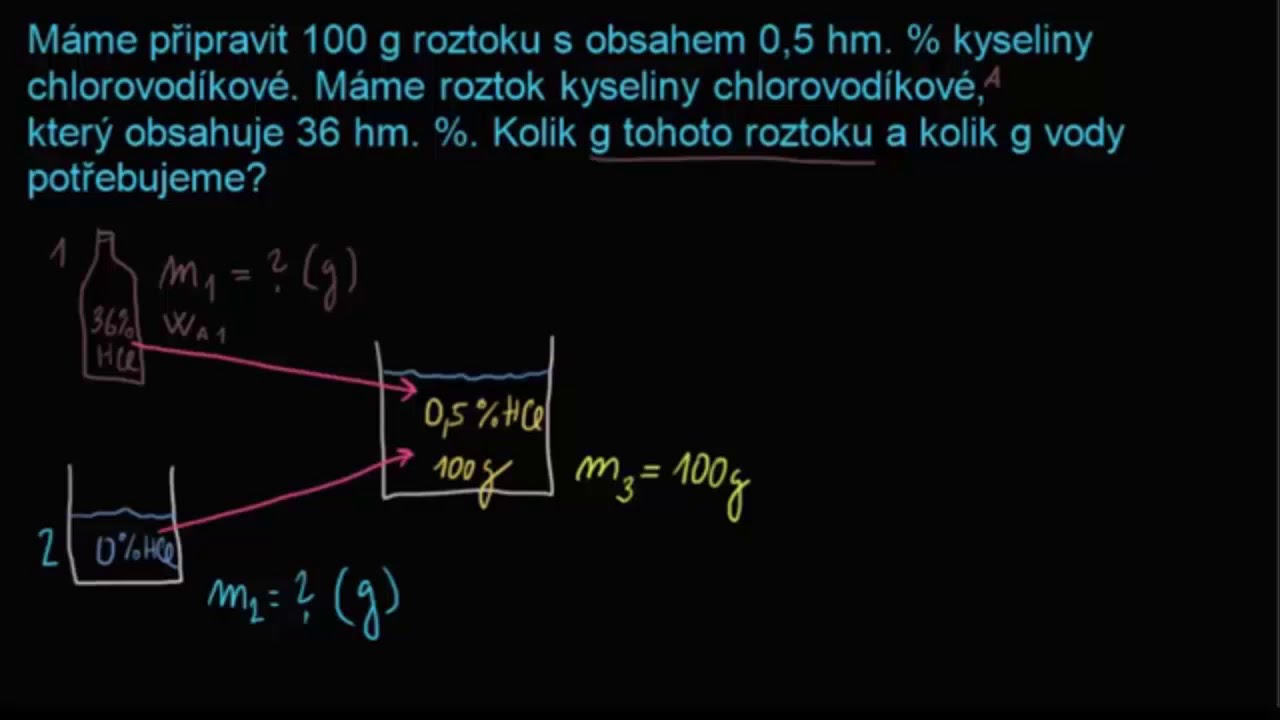
Co je 10% roztok
100/80 = 31,25% Page 5 3) 10% roztok obsahuje 10 g rozpuštěné látky a 90 g rozpouštědla.Příklad: Máme připravit 1 % (w/v) NaCl. Použijeme tedy 1 g NaCl, který rozpustíme v daném roztokku (případně ve vodě) a doplníme do výsledného objemu 100 ml. Výpočet molární koncentrace z procentuální koncentrace: Při tomto výpočtu je třeba znát údaj o molární hmotnosti dané látky (MW) a její hustotě.Tavenina je roztavená látka nebo směs. V geologii se pod pojmem tavenina většinou popisuje magma. Magma ale obvykle není čistá tavenina, jde povětšinou o směs tavenin.
Příklad: Máme připravit 1 % (w/v) NaCl. Použijeme tedy 1 g NaCl, který rozpustíme v daném roztokku (případně ve vodě) a doplníme do výsledného objemu 100 ml. Výpočet molární koncentrace z procentuální koncentrace: Při tomto výpočtu je třeba znát údaj o molární hmotnosti dané látky (MW) a její hustotě.
Jak pripravit 20% roztok : Příklad: Příprava 20 % (w/w) NaCl. 20 g NaCl je rozpuštěno ve 100 g výsledného roztoku. Objemová procenta (v/v) jsou definována jako počet mililitrů látky na 100 ml výsledného roztoku.
Jak se počítá roztok : c = n/V. Obvykle se látková koncentrace vyjadřuje v jednotkách mol/l (mol dm–3) a můžeme se setkat se starším značením 1 mol/l = 1 M. Vypočítejte látkovou koncentraci NaCl ve 200 ml roztoku, na jehož přípravu jsme použili 10 g NaCl (M = 58,44 g/mol).
Co znamená 2M roztok
2M znamená, že roztok je dvoumolární, tedy s koncentrací 2 mol/dm3. Je možné použít i násobných předpon, např. mM pak znamená milimolární (mmol/dm3), μM znamená mikromolární (μmol/dm3) atd. Tento způsob vyjadřování koncentrace se velmi často používá v analytické chemii.
Směs se skládá z více chemických látek. Při jejich mísení nedochází ke změnám vazeb. Mohou se však měnit fyzikální vlastnosti: např. voda se solí má nižší teplotu tání než čistá voda.V závislosti na vnějších podmínkách mohou být homogenní směsi:
Jak připravit 20% roztok : Příklad: Příprava 20 % (w/w) NaCl. 20 g NaCl je rozpuštěno ve 100 g výsledného roztoku. Objemová procenta (v/v) jsou definována jako počet mililitrů látky na 100 ml výsledného roztoku.