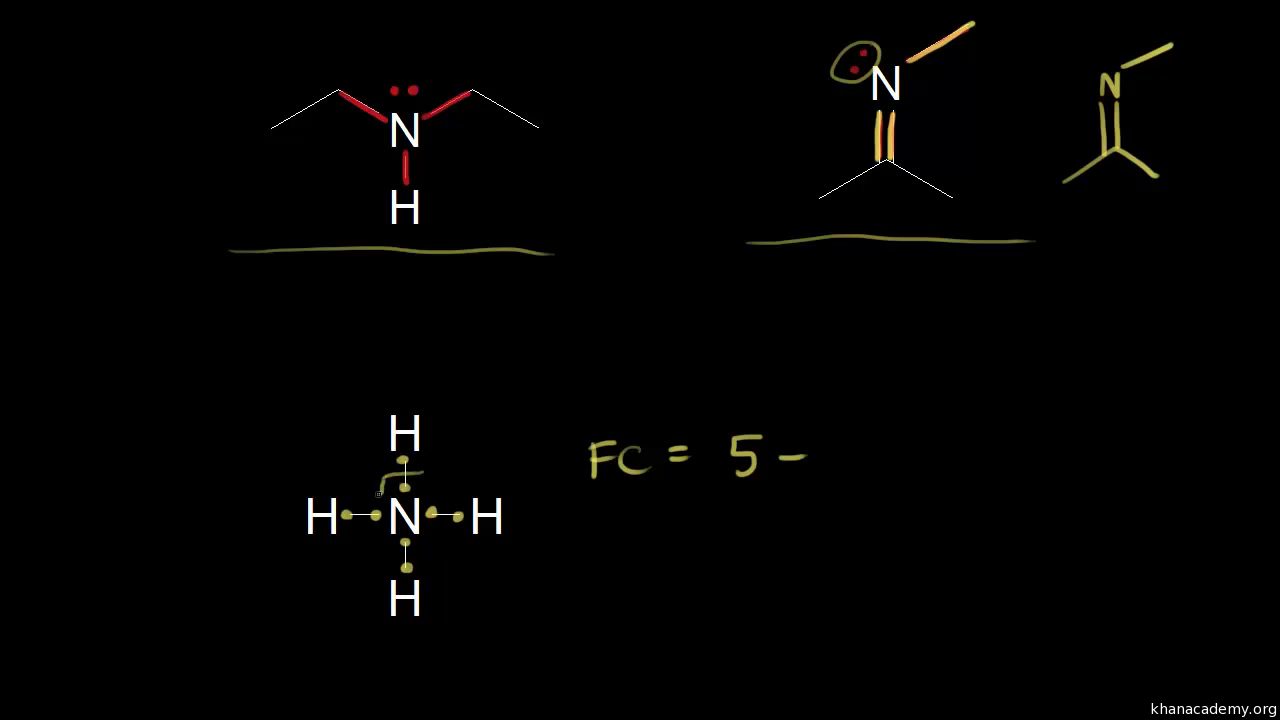
Dvojice elektronů, které jsou spárovány, ale neúčastní se chemické vazby, jsou volné elektronové páry.Pokud budeme chtít napsat elektronový vzorec musíme si uvědomit, že atom chloru obsahuje i volné elektronové páry nepodílející se na vzniku chemické vazby. Tyto páry je nutné do elektronového vzorce zahrnout: každý elektronový pár se značí čárkou kolem chemické značky daného prvku. Atom chloru má tyto páry tři.Takto zakreslený kyslík má 3 volné elektronové páry. Z vazebného páru (na obrázku směruje od kyslíku doprava) mu přiřadíme 1 elektron. Celkem má tedy takový kyslík 7 elektronů.
Co to je Nevazebný elektronový pár : Elektronový pár se ve vzorci vyznačuje čárkou (čárka v elektronovém strukturním vzorci tedy znamená 2 valenční elektrony). Tato čárka se ve vzorci nachází buď na spojnici dvou atomů (pak se jedná o vazebný elektronový pár), nebo je dopsána k symbolu jednoho atomu (pak se jedná o nevazebný elektronový pár).
Kde se nachází volné elektrony
V kovech jsou to volné elektrony, v kapalinách a ionizovaných plynech kladné a záporné ionty, ve vakuu jakékoli nabité částice. Ke vzniku elektrického proudu nestačí jen přítomnost nabitých částic. Je nutné, aby se částice daly do pohybu.
Jak vzniká volný elektron : Elektrony mohou být vázané nebo volné. Elektrony mohou svou dráhu opustit vlivem vnějšího elektrického pole nebo teploty. Tyto elektrony se nazývají volné a pohybují se zcela náhodně. Po připojení elektrického napětí vzniká elektrické pole, které udává směr pohybu volných elektronů a tím vytváří elektrický proud.
Obecně platí, že kovalentní vazby jsou mezi atomy dvou nekovových prvků (nekov-nekov), iontové vazby mezi kovem a nekovem (kov-nekov) a kovová vazba je mezi atomy kovů (kov-kov – v tomto případě se jedná o vysoký počet atomů kovu vzájemně sdílejících elektrony). protonové (atomové) číslo Z – je rovno počtu protonů v jádře, udává také počet elektronů obíhajících kolem jádra.
Proč má kyslík oxidační číslo 2
Proč má prvek kyslík ve sloučeninách oxidační číslo –II Kyslíku chybí 2 elektrony k zaplnění vrstvy. Po přijetí 2 elektronů bude mít 8p+ a 10e-. Náboj částice je -2,tedy oxidační číslo je –II.Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se atom nachází v periodické tabulce objevené D. I. Mendělejevem. V tabulce jsou uvedeny prvky periodické tabulky podle jejich pořadí, které zároveň udává počet elektronů v jejich elektronovém obalu.Obecně platí, že počet valenčních elektronů je stejný jako číslo sloupce a roste v rámci řádku zleva doprava. Prvky skupiny 1 mají jeden valenční elektron a prvky skupiny 18 mají osm valenčních elektronů až na helium, které má celkem pouze dva elektrony. Atom kyslíku O je dvojvazný, neboť obsahuje ve svém orbitalu 2p 2 nespárované elektrony. Polární vazba se vytváří mezi atomy, jejichž rozdíl hodnot elektronegativit leží v intervalu 0,4 – 1,7. Příkladem ketonů jsou také sloučeniny, u kterých je atom kyslíku O vázán přímo na uhlovodíkový cyklus.
Co je volné elektrony : Elektrony mohou svou dráhu opustit vlivem vnějšího elektrického pole nebo teploty. Tyto elektrony se nazývají volné a pohybují se zcela náhodně. Po připojení elektrického napětí vzniká elektrické pole, které udává směr pohybu volných elektronů a tím vytváří elektrický proud.
Jak zjistit počet elektronů : V neutrálním atomu je počet protonů stejný jako počet elektronů, a proto počet elektronů můžeme snadno určit z atomového čísla. Navíc pozice prvku v periodické tabulce—sloupec, skupina, řádek nebo perioda—poskytují užitečné informace o uspořádání elektronů ve slupkách.
Jaká je podstata kovové vazby
Kovová vazba vzniká mezi atomy kovu v tuhém stavu a je způsobena elektrostatickou přitažlivostí kationtů kovů a volně se pohybujících valenčních elektronů. Zjednodušeně chápaná kovová mřížka je znázorněna na Obr. 18-1. Předpokládá se, že v krystalu kovu jsou pravidelně uspořádaná jádra atomů kovu (včetně elektronů tzv. Vazba V8 šitá (pevné desky)
Jedná se o knihu v pevných deskách. Knižní blok je ušitý nití a za předsádky vlepený do knižních desek. Kniha je opatřena stužkou, kapitálkem. Možnost kulatého hřbetu od 2 cm tloušťky knihy.Elektronová konfigurace a periodická tabulka
V neutrálním atomu je počet protonů stejný jako počet elektronů, a proto počet elektronů můžeme snadno určit z atomového čísla. Navíc pozice prvku v periodické tabulce—sloupec, skupina, řádek nebo perioda—poskytují užitečné informace o uspořádání elektronů ve slupkách.
Jak zjistím oxidační čísla : Oxidační číslo píšeme římskou číslicí, znaménko „plus/mínus“ píšeme před číslici (např. +II; –IV), kladné oxidační stavy se někdy píšou i bez znaménka plus. Arabské číslice používáme pro vyjádření náboje jednoatomových nebo víceatomových iontů.
Antwort Jak poznat volný elektronový pár? Weitere Antworten – Co je to volný elektronový pár
Dvojice elektronů, které jsou spárovány, ale neúčastní se chemické vazby, jsou volné elektronové páry.Pokud budeme chtít napsat elektronový vzorec musíme si uvědomit, že atom chloru obsahuje i volné elektronové páry nepodílející se na vzniku chemické vazby. Tyto páry je nutné do elektronového vzorce zahrnout: každý elektronový pár se značí čárkou kolem chemické značky daného prvku. Atom chloru má tyto páry tři.Takto zakreslený kyslík má 3 volné elektronové páry. Z vazebného páru (na obrázku směruje od kyslíku doprava) mu přiřadíme 1 elektron. Celkem má tedy takový kyslík 7 elektronů.
Co to je Nevazebný elektronový pár : Elektronový pár se ve vzorci vyznačuje čárkou (čárka v elektronovém strukturním vzorci tedy znamená 2 valenční elektrony). Tato čárka se ve vzorci nachází buď na spojnici dvou atomů (pak se jedná o vazebný elektronový pár), nebo je dopsána k symbolu jednoho atomu (pak se jedná o nevazebný elektronový pár).
Kde se nachází volné elektrony
V kovech jsou to volné elektrony, v kapalinách a ionizovaných plynech kladné a záporné ionty, ve vakuu jakékoli nabité částice. Ke vzniku elektrického proudu nestačí jen přítomnost nabitých částic. Je nutné, aby se částice daly do pohybu.
Jak vzniká volný elektron : Elektrony mohou být vázané nebo volné. Elektrony mohou svou dráhu opustit vlivem vnějšího elektrického pole nebo teploty. Tyto elektrony se nazývají volné a pohybují se zcela náhodně. Po připojení elektrického napětí vzniká elektrické pole, které udává směr pohybu volných elektronů a tím vytváří elektrický proud.
Obecně platí, že kovalentní vazby jsou mezi atomy dvou nekovových prvků (nekov-nekov), iontové vazby mezi kovem a nekovem (kov-nekov) a kovová vazba je mezi atomy kovů (kov-kov – v tomto případě se jedná o vysoký počet atomů kovu vzájemně sdílejících elektrony).
protonové (atomové) číslo Z – je rovno počtu protonů v jádře, udává také počet elektronů obíhajících kolem jádra.
Proč má kyslík oxidační číslo 2
Proč má prvek kyslík ve sloučeninách oxidační číslo –II Kyslíku chybí 2 elektrony k zaplnění vrstvy. Po přijetí 2 elektronů bude mít 8p+ a 10e-. Náboj částice je -2,tedy oxidační číslo je –II.Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se atom nachází v periodické tabulce objevené D. I. Mendělejevem. V tabulce jsou uvedeny prvky periodické tabulky podle jejich pořadí, které zároveň udává počet elektronů v jejich elektronovém obalu.Obecně platí, že počet valenčních elektronů je stejný jako číslo sloupce a roste v rámci řádku zleva doprava. Prvky skupiny 1 mají jeden valenční elektron a prvky skupiny 18 mají osm valenčních elektronů až na helium, které má celkem pouze dva elektrony.

Atom kyslíku O je dvojvazný, neboť obsahuje ve svém orbitalu 2p 2 nespárované elektrony. Polární vazba se vytváří mezi atomy, jejichž rozdíl hodnot elektronegativit leží v intervalu 0,4 – 1,7. Příkladem ketonů jsou také sloučeniny, u kterých je atom kyslíku O vázán přímo na uhlovodíkový cyklus.
Co je volné elektrony : Elektrony mohou svou dráhu opustit vlivem vnějšího elektrického pole nebo teploty. Tyto elektrony se nazývají volné a pohybují se zcela náhodně. Po připojení elektrického napětí vzniká elektrické pole, které udává směr pohybu volných elektronů a tím vytváří elektrický proud.
Jak zjistit počet elektronů : V neutrálním atomu je počet protonů stejný jako počet elektronů, a proto počet elektronů můžeme snadno určit z atomového čísla. Navíc pozice prvku v periodické tabulce—sloupec, skupina, řádek nebo perioda—poskytují užitečné informace o uspořádání elektronů ve slupkách.
Jaká je podstata kovové vazby
Kovová vazba vzniká mezi atomy kovu v tuhém stavu a je způsobena elektrostatickou přitažlivostí kationtů kovů a volně se pohybujících valenčních elektronů. Zjednodušeně chápaná kovová mřížka je znázorněna na Obr. 18-1. Předpokládá se, že v krystalu kovu jsou pravidelně uspořádaná jádra atomů kovu (včetně elektronů tzv.
Vazba V8 šitá (pevné desky)
Jedná se o knihu v pevných deskách. Knižní blok je ušitý nití a za předsádky vlepený do knižních desek. Kniha je opatřena stužkou, kapitálkem. Možnost kulatého hřbetu od 2 cm tloušťky knihy.Elektronová konfigurace a periodická tabulka
V neutrálním atomu je počet protonů stejný jako počet elektronů, a proto počet elektronů můžeme snadno určit z atomového čísla. Navíc pozice prvku v periodické tabulce—sloupec, skupina, řádek nebo perioda—poskytují užitečné informace o uspořádání elektronů ve slupkách.
Jak zjistím oxidační čísla : Oxidační číslo píšeme římskou číslicí, znaménko „plus/mínus“ píšeme před číslici (např. +II; –IV), kladné oxidační stavy se někdy píšou i bez znaménka plus. Arabské číslice používáme pro vyjádření náboje jednoatomových nebo víceatomových iontů.