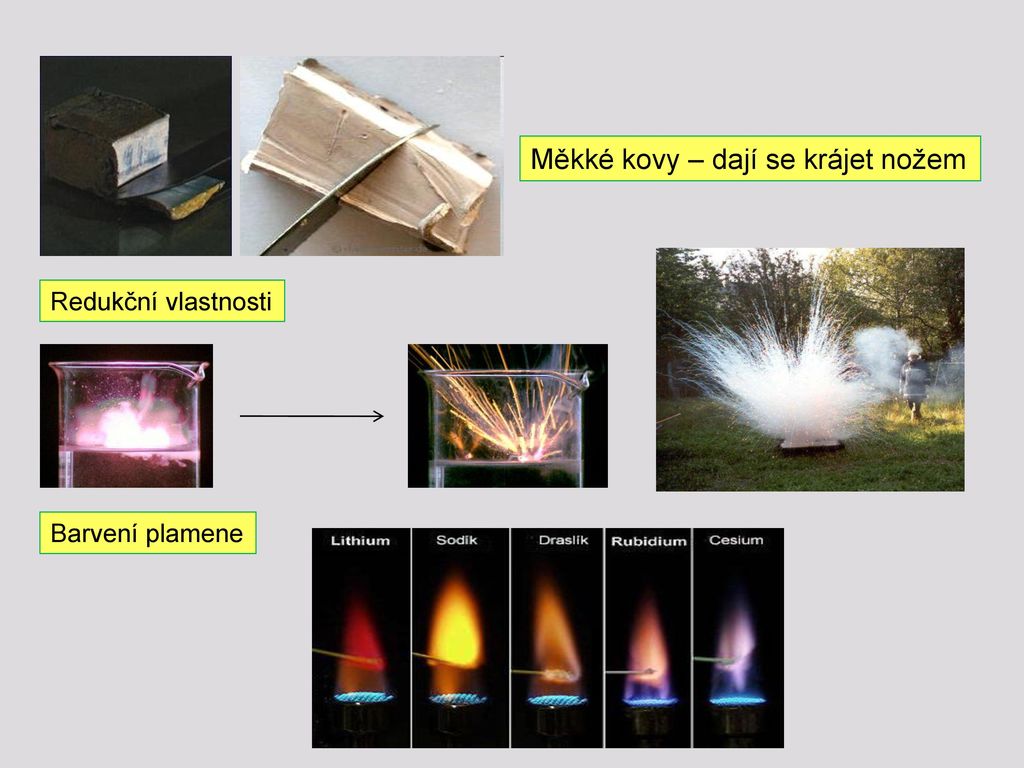
Kationty kovů se působením tepla uvolňují ze svých solí a barví plamen. Sodík žlutě, baryum zeleně a lithium barví plamen do červena.Lithium se stejně jako i ostatní alkalické kovy vyskytuje pouze v oxidačním stavu Li+. Soli lithia barví plamen karmínově červeně.Hoření hořčíku
Hořčík pak zasuneme do plamene kahanu a počkáme, dokud se nevznítí oslnivě bílým plamenem.
Co je to alkalický kov : Alkalické kovy jsou členy 1. skupiny periodické tabulky. Mezi alkalické kovy patří lithium, sodík, draslík, rubidium, cesium a francium. Tyto prvky jsou velmi reaktivní a v přírodě se nacházejí pouze ve sloučeninách.
Jak barví plamen
Nádherně barví plamen zejména prvky, jež náleží mezi alkalické kovy či kovy alkalických zemin. Například lithium zabarvuje plamen purpurově červeně, draslík růžovofialově, cesium a rubidium fialově, vápník oranžovočerveně, stroncium karmínově červeně a baryum zeleně.
Co barví plamen do modra : Zabarvení ohně do modra – pro temně modrý až středně modrý nádech plamene slouží sloučeniny mědi (Cu), pro světlejší modrý nádech plamene sloučeniny rtuti (Hg). Zabarvení ohně do žluta – při použití sloučenin sodíku (Na).
Nádherně barví plamen zejména prvky, jež náleží mezi alkalické kovy či kovy alkalických zemin. Například lithium zabarvuje plamen purpurově červeně, draslík růžovofialově, cesium a rubidium fialově, vápník oranžovočerveně, stroncium karmínově červeně a baryum zeleně. Účinky hořčíku
Je důležitý při syntéze bílkovin. Přispívá k elektrolytové rovnováze a normálnímu enrgetickému metabolismu. Přispívá k normální činnosti nervové soustavy a svalů. Podporuje psychiku a snižuje míru únavy a vyčerpání.
Co způsobuje přebytek hořčíku
Tělo udržuje své vnitřní prostředí v rovnováze podle svých potřeb, proto k předávkování hořčíkem normální cestou (např. pokud vypijete větší množství minerálky bohaté na hořčík) naštěstí téměř není možné. Vaše tělo jeho nadbytek jednoduše přirozenou cestou vyloučí. Z toho důvodu přebytek hořčíku může vyvolat průjmy.Alkalické kovy se v přírodě vyskytují pouze jako jednomocné kationy M+, nejčastěji ve formě rozpustných solí. Jako elementární kovy se v přírodě nenalézají. Výroba alkalických kovů se nejčastěji provádí elektrolýzou taveniny jejich solí (většinou chloridů) nebo hydroxidů.Alkalické kovy mají velmi nízkou hustotu, například hustota lithia je 0,534 g•cm-3. Bouřlivě reagují s vodou (za vzniku vodíku a hydroxidu) nebo halogeny (prvky VII. A skupiny – fluor, chlor, brom, jod), kdy vznikají příslušné halogenidy. Jak můžeme plamen obarvit Světlo plamene vznikne, když se částice horkého plynu (pro zjednodušení uvažujme o atomech) zbavují energie. Protože přesně dané spektrum barev, kterými může atom svítit, je pro každý prvek jiné, existují prvky u kterých výrazně převáží jedna barva.
Jak změnit barvu ohně : Nádherně barví plamen zejména prvky, jež náleží mezi alkalické kovy či kovy alkalických zemin. Například lithium zabarvuje plamen purpurově červeně, draslík růžovofialově, cesium a rubidium fialově, vápník oranžovočerveně, stroncium karmínově červeně a baryum zeleně.
Jak hoří vápník : Vápník hoří cihlovým plamenem. Stabilním oxidačním stavem je oxidační stav II. Elektronegativita těchto kovů 2A ve srovnání s elektronegativitou alkalických kovů poněkud vyšší. Jsou schopné vytvářet kovalentní vazby i s poměrně elektronegativními vazebnými partnery.
Kdy brát hořčík ráno nebo večer
Hořčík malát má spíše energizující účinky, proto jej doporučujeme užívat ráno. Co může způsobit dlouhodobý nedostatek hořčíku V počáteční fázi se nedostatek hořčíku projevuje především zvýšenou únavou, slabostí, bolestmi hlavy a podrážděností. Později se přidává brnění končetin, svalové křeče, případně cukání v oku. Nezřídka následuje psychická nerovnováha vedoucí až k úzkostem a depresím.Užívat byste měli hořčík nejpozději půl hodiny před spaním.
Proč se alkalické kovy a kovy alkalických zemin vyskytují pouze ve sloučeninách : Všechny kovy alkalických zemin se v přírodě vyskytují v podobě svých sloučenin. Jelikož tyto sloučeniny nejsou iontového charakteru, tak se na rozdíl od alkalických kovů vyskytují především jako minerály, které vytvářejí povrch naší planety.
Antwort Jak barví plamen alkalické kovy? Weitere Antworten – Proč alkalické kovy barví plamen
Kationty kovů se působením tepla uvolňují ze svých solí a barví plamen. Sodík žlutě, baryum zeleně a lithium barví plamen do červena.Lithium se stejně jako i ostatní alkalické kovy vyskytuje pouze v oxidačním stavu Li+. Soli lithia barví plamen karmínově červeně.Hoření hořčíku
Hořčík pak zasuneme do plamene kahanu a počkáme, dokud se nevznítí oslnivě bílým plamenem.

Co je to alkalický kov : Alkalické kovy jsou členy 1. skupiny periodické tabulky. Mezi alkalické kovy patří lithium, sodík, draslík, rubidium, cesium a francium. Tyto prvky jsou velmi reaktivní a v přírodě se nacházejí pouze ve sloučeninách.
Jak barví plamen
Nádherně barví plamen zejména prvky, jež náleží mezi alkalické kovy či kovy alkalických zemin. Například lithium zabarvuje plamen purpurově červeně, draslík růžovofialově, cesium a rubidium fialově, vápník oranžovočerveně, stroncium karmínově červeně a baryum zeleně.
Co barví plamen do modra : Zabarvení ohně do modra – pro temně modrý až středně modrý nádech plamene slouží sloučeniny mědi (Cu), pro světlejší modrý nádech plamene sloučeniny rtuti (Hg). Zabarvení ohně do žluta – při použití sloučenin sodíku (Na).
Nádherně barví plamen zejména prvky, jež náleží mezi alkalické kovy či kovy alkalických zemin. Například lithium zabarvuje plamen purpurově červeně, draslík růžovofialově, cesium a rubidium fialově, vápník oranžovočerveně, stroncium karmínově červeně a baryum zeleně.
Účinky hořčíku
Je důležitý při syntéze bílkovin. Přispívá k elektrolytové rovnováze a normálnímu enrgetickému metabolismu. Přispívá k normální činnosti nervové soustavy a svalů. Podporuje psychiku a snižuje míru únavy a vyčerpání.
Co způsobuje přebytek hořčíku
Tělo udržuje své vnitřní prostředí v rovnováze podle svých potřeb, proto k předávkování hořčíkem normální cestou (např. pokud vypijete větší množství minerálky bohaté na hořčík) naštěstí téměř není možné. Vaše tělo jeho nadbytek jednoduše přirozenou cestou vyloučí. Z toho důvodu přebytek hořčíku může vyvolat průjmy.Alkalické kovy se v přírodě vyskytují pouze jako jednomocné kationy M+, nejčastěji ve formě rozpustných solí. Jako elementární kovy se v přírodě nenalézají. Výroba alkalických kovů se nejčastěji provádí elektrolýzou taveniny jejich solí (většinou chloridů) nebo hydroxidů.Alkalické kovy mají velmi nízkou hustotu, například hustota lithia je 0,534 g•cm-3. Bouřlivě reagují s vodou (za vzniku vodíku a hydroxidu) nebo halogeny (prvky VII. A skupiny – fluor, chlor, brom, jod), kdy vznikají příslušné halogenidy.

Jak můžeme plamen obarvit Světlo plamene vznikne, když se částice horkého plynu (pro zjednodušení uvažujme o atomech) zbavují energie. Protože přesně dané spektrum barev, kterými může atom svítit, je pro každý prvek jiné, existují prvky u kterých výrazně převáží jedna barva.
Jak změnit barvu ohně : Nádherně barví plamen zejména prvky, jež náleží mezi alkalické kovy či kovy alkalických zemin. Například lithium zabarvuje plamen purpurově červeně, draslík růžovofialově, cesium a rubidium fialově, vápník oranžovočerveně, stroncium karmínově červeně a baryum zeleně.
Jak hoří vápník : Vápník hoří cihlovým plamenem. Stabilním oxidačním stavem je oxidační stav II. Elektronegativita těchto kovů 2A ve srovnání s elektronegativitou alkalických kovů poněkud vyšší. Jsou schopné vytvářet kovalentní vazby i s poměrně elektronegativními vazebnými partnery.
Kdy brát hořčík ráno nebo večer
Hořčík malát má spíše energizující účinky, proto jej doporučujeme užívat ráno.

Co může způsobit dlouhodobý nedostatek hořčíku V počáteční fázi se nedostatek hořčíku projevuje především zvýšenou únavou, slabostí, bolestmi hlavy a podrážděností. Později se přidává brnění končetin, svalové křeče, případně cukání v oku. Nezřídka následuje psychická nerovnováha vedoucí až k úzkostem a depresím.Užívat byste měli hořčík nejpozději půl hodiny před spaním.
Proč se alkalické kovy a kovy alkalických zemin vyskytují pouze ve sloučeninách : Všechny kovy alkalických zemin se v přírodě vyskytují v podobě svých sloučenin. Jelikož tyto sloučeniny nejsou iontového charakteru, tak se na rozdíl od alkalických kovů vyskytují především jako minerály, které vytvářejí povrch naší planety.