) určuje orientaci orbitalu v prostoru; magnetický orbitální moment (pohyb elektrického náboje vytváří magnetické pole) má opačný směr než orbitální moment hybnosti.Kvantová čísla jsou čísla, kterými se v kvantové mechanice popisují vlastnosti určitých částic v systému; každé číslo odpovídá jedné zachovávané veličině. Nejčastějším použitím kvantových čísel je popis elektronů a jejich orbitalů v atomovém obalu, například v chemii.Spinové kvantové číslo je v atomové fyzice kvantové číslo, které parametrizuje vnitřní moment hybnosti (spinový moment hybnosti nebo prostě spin) dané částice.
Jak se značí magnetické kvantové číslo : Magnetické kvantové číslo označujeme ml. Nabývá celočíselných hodnot od –l do + l, včetně nuly. Hodnota ml udává orientaci příslušného AO vůči osám x, y, z v trojrozměrném prostoru.
Co udava Spinove číslo
Spinové kvantové číslo s popisuje vnitřní moment hybnosti, případně rotaci elektonu. Matematicky nabývá hodnot +0,5 nebo -0,5. Z toho také vyplývá Pauliho vylučovací princip: v jednom atomu se mohou vyskytovat 2 elektrony se stejnými n, l, m, ale musí se lišit spinovým kvantovým číslem.
Kolik je kvantových čísel : Ukážeme si, jak jsou orbitaly a elektrony v nich popisovány pomocí 4 kvantových čísel. Tuto čtveřici čísel přirovnáme pro lepší zapamatování k adrese a činnosti obyvatele obce. Uvedeme si také Pauliho princip výlučnosti, který říká, že žádné dva elektrony v atomu se nemohou shodovat ve všech 4 kvantových číslech.
Souvisí s energií elektronů a velikostí orbitalů (čím větší n, tím se elektrony mohou nacházet dále od jádra). Vedlejší kvantové číslo ( l) udává typ orbitalu, spočítá se dle vztahu l = n − 1 l = n – 1 l=n−1. Podle vedlejšího kvantového čísla se orbitaly označují písmeny: 0 = s, 1 = p, 2 = d, 3 = f. Hlavní kvantové číslo (značené n) je v kvantové mechanice jedno ze čtyř kvantových čísel přiřazených každému elektronu v atomu k popisu stavu elektronu. Jedná se o diskrétní proměnnou, nabývá tedy celočíselných hodnot. Zvýšení n vede ke zvýšení počtu elektronových slupek a elektron tedy stráví více času dále od jádra.
Co nám udává vedlejší kvantové číslo
Vedlejší kvantové číslo (označováno písmenem l) je závislé na hlavním kvantovém čísle (n) a jeho maximální hodnotu lze vypočítat jako l=n-1. Charakterizuje orbitální moment hybnosti elektronu a tvar (prostorovou náročnost) orbitalu.Hlavní kvantové číslo (značené n) je v kvantové mechanice jedno ze čtyř kvantových čísel přiřazených každému elektronu v atomu k popisu stavu elektronu. Jedná se o diskrétní proměnnou, nabývá tedy celočíselných hodnot. Zvýšení n vede ke zvýšení počtu elektronových slupek a elektron tedy stráví více času dále od jádra.Kvantová fyzika si klade za cíl předpovídat hodnoty pozorovatelných (experimentálně měřitelných) fyzikálních veličin. Stav systému (soubor mikroobjektů; např. elektronů v molekule nebo atomu) je popsán funkcí Y, která obsahuje veškerou informaci, kterou lze o systému (experimentálně) zjistit. Hlavní kvantové číslo představuje relativní celkovou energii každého orbitalu a energie každého orbitalu se zvyšuje se zvětšující se vzdáleností od atomového jádra. Sady orbitalů se stejnou hodnotou n jsou často označovány jako elektronové vrstvy nebo úrovně energie.
Jak funguje kvantování : Kvantování je ve fyzice proces, při kterém se klasické fyzikální objekty a veličiny popisující jejich chování nahrazují odpovídajícími matematickými strukturami kvantové teorie (např. operátory, vlnová funkce, stavový vektor, dráhový integrál apod.)
Co znamená že má elektromagnetické záření kvantovou povahu : Podle této hypotézy zdroje záření nevyzařují ani neabsorbují energii spojitě, ale diskrétně, po malých částech, nazývaných kvanta energie. Toto kvantum energie nazval Einstein foton a experimentálně byly potvrzeny jeho částicové vlastnosti.
Co urcuje Protonove cislo
protonové (atomové) číslo Z – je rovno počtu protonů v jádře, udává také počet elektronů obíhajících kolem jádra. nukleonové (hmotnostní) číslo A – je rovno počtu nukleonů v jádře, tj. A = Z + N. Kvantová mechanika popisuje děje probíhající na jemné úrovni rozlišení, kdy charakteristické rozdíly akce S=∫Ldt (kde L značí lagrangián, tedy okamžitý rozdíl kinetické a potenciální energie) mezi dvěma možnými průběhy děje jsou srovnatelné s hodnotou Planckovy konstanty (ħ = 1,054·10−34 J·s).Kvantový skok je kvalitativní změna k lepšímu.
A uskutečňuje se pod tlakem (někdy se tomu říká alchymie). Onen tlak je navozen okolnostmi, člověk zneklidní a probudí se v něm vnitřní tlaky. Ty tlaky jsou tu od toho aby ke kvantovému skoku neboli změně kvality vnímání k lepšímu.
Jaké hodnoty má viditelné světlo : Viditelné světlo, jinak také označované pouze jako světlo, je elektromagnetické záření o frekvenci 3,9 x 1014 Hz do 7,9 x 1014 Hz, což ve vakuu odpovídá vlnovým délkám v rozmezí 380–740 nm.
Antwort Co udava magneticke Kvantove cislo? Weitere Antworten – Co udava magneticke cislo
Magnetické kvantové číslo ml
) určuje orientaci orbitalu v prostoru; magnetický orbitální moment (pohyb elektrického náboje vytváří magnetické pole) má opačný směr než orbitální moment hybnosti.Kvantová čísla jsou čísla, kterými se v kvantové mechanice popisují vlastnosti určitých částic v systému; každé číslo odpovídá jedné zachovávané veličině. Nejčastějším použitím kvantových čísel je popis elektronů a jejich orbitalů v atomovém obalu, například v chemii.Spinové kvantové číslo je v atomové fyzice kvantové číslo, které parametrizuje vnitřní moment hybnosti (spinový moment hybnosti nebo prostě spin) dané částice.

Jak se značí magnetické kvantové číslo : Magnetické kvantové číslo označujeme ml. Nabývá celočíselných hodnot od –l do + l, včetně nuly. Hodnota ml udává orientaci příslušného AO vůči osám x, y, z v trojrozměrném prostoru.
Co udava Spinove číslo
Spinové kvantové číslo s popisuje vnitřní moment hybnosti, případně rotaci elektonu. Matematicky nabývá hodnot +0,5 nebo -0,5. Z toho také vyplývá Pauliho vylučovací princip: v jednom atomu se mohou vyskytovat 2 elektrony se stejnými n, l, m, ale musí se lišit spinovým kvantovým číslem.
Kolik je kvantových čísel : Ukážeme si, jak jsou orbitaly a elektrony v nich popisovány pomocí 4 kvantových čísel. Tuto čtveřici čísel přirovnáme pro lepší zapamatování k adrese a činnosti obyvatele obce. Uvedeme si také Pauliho princip výlučnosti, který říká, že žádné dva elektrony v atomu se nemohou shodovat ve všech 4 kvantových číslech.
Souvisí s energií elektronů a velikostí orbitalů (čím větší n, tím se elektrony mohou nacházet dále od jádra). Vedlejší kvantové číslo ( l) udává typ orbitalu, spočítá se dle vztahu l = n − 1 l = n – 1 l=n−1. Podle vedlejšího kvantového čísla se orbitaly označují písmeny: 0 = s, 1 = p, 2 = d, 3 = f.
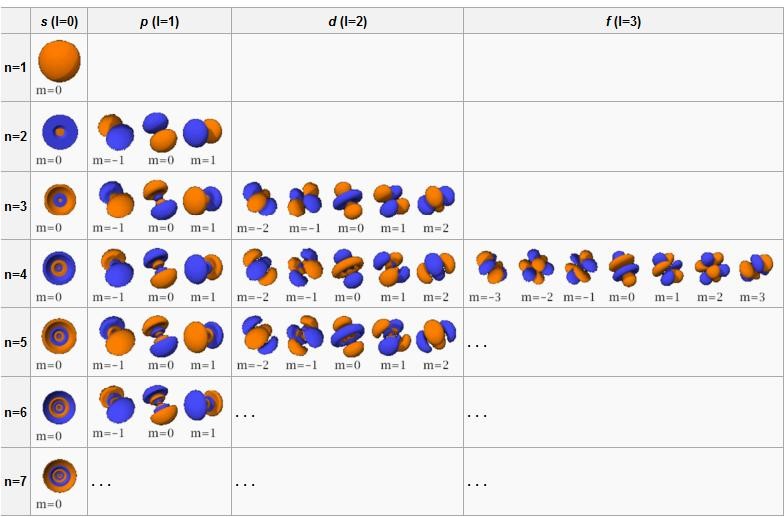
Hlavní kvantové číslo (značené n) je v kvantové mechanice jedno ze čtyř kvantových čísel přiřazených každému elektronu v atomu k popisu stavu elektronu. Jedná se o diskrétní proměnnou, nabývá tedy celočíselných hodnot. Zvýšení n vede ke zvýšení počtu elektronových slupek a elektron tedy stráví více času dále od jádra.
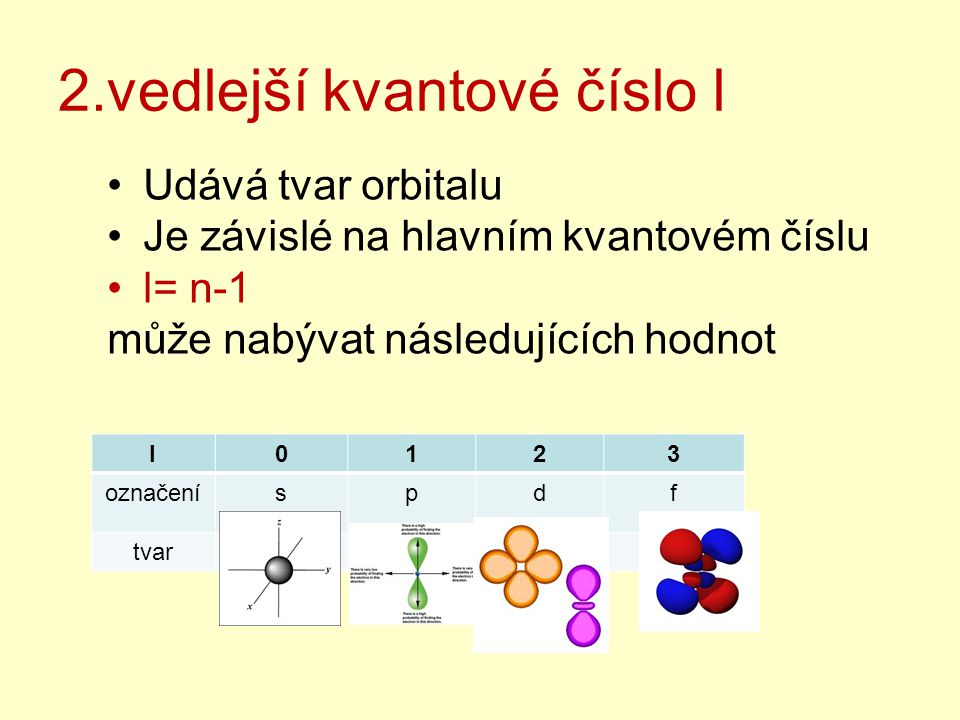
Co nám udává vedlejší kvantové číslo
Vedlejší kvantové číslo (označováno písmenem l) je závislé na hlavním kvantovém čísle (n) a jeho maximální hodnotu lze vypočítat jako l=n-1. Charakterizuje orbitální moment hybnosti elektronu a tvar (prostorovou náročnost) orbitalu.Hlavní kvantové číslo (značené n) je v kvantové mechanice jedno ze čtyř kvantových čísel přiřazených každému elektronu v atomu k popisu stavu elektronu. Jedná se o diskrétní proměnnou, nabývá tedy celočíselných hodnot. Zvýšení n vede ke zvýšení počtu elektronových slupek a elektron tedy stráví více času dále od jádra.Kvantová fyzika si klade za cíl předpovídat hodnoty pozorovatelných (experimentálně měřitelných) fyzikálních veličin. Stav systému (soubor mikroobjektů; např. elektronů v molekule nebo atomu) je popsán funkcí Y, která obsahuje veškerou informaci, kterou lze o systému (experimentálně) zjistit.
Hlavní kvantové číslo představuje relativní celkovou energii každého orbitalu a energie každého orbitalu se zvyšuje se zvětšující se vzdáleností od atomového jádra. Sady orbitalů se stejnou hodnotou n jsou často označovány jako elektronové vrstvy nebo úrovně energie.
Jak funguje kvantování : Kvantování je ve fyzice proces, při kterém se klasické fyzikální objekty a veličiny popisující jejich chování nahrazují odpovídajícími matematickými strukturami kvantové teorie (např. operátory, vlnová funkce, stavový vektor, dráhový integrál apod.)
Co znamená že má elektromagnetické záření kvantovou povahu : Podle této hypotézy zdroje záření nevyzařují ani neabsorbují energii spojitě, ale diskrétně, po malých částech, nazývaných kvanta energie. Toto kvantum energie nazval Einstein foton a experimentálně byly potvrzeny jeho částicové vlastnosti.
Co urcuje Protonove cislo
protonové (atomové) číslo Z – je rovno počtu protonů v jádře, udává také počet elektronů obíhajících kolem jádra. nukleonové (hmotnostní) číslo A – je rovno počtu nukleonů v jádře, tj. A = Z + N.

Kvantová mechanika popisuje děje probíhající na jemné úrovni rozlišení, kdy charakteristické rozdíly akce S=∫Ldt (kde L značí lagrangián, tedy okamžitý rozdíl kinetické a potenciální energie) mezi dvěma možnými průběhy děje jsou srovnatelné s hodnotou Planckovy konstanty (ħ = 1,054·10−34 J·s).Kvantový skok je kvalitativní změna k lepšímu.
A uskutečňuje se pod tlakem (někdy se tomu říká alchymie). Onen tlak je navozen okolnostmi, člověk zneklidní a probudí se v něm vnitřní tlaky. Ty tlaky jsou tu od toho aby ke kvantovému skoku neboli změně kvality vnímání k lepšímu.
Jaké hodnoty má viditelné světlo : Viditelné světlo, jinak také označované pouze jako světlo, je elektromagnetické záření o frekvenci 3,9 x 1014 Hz do 7,9 x 1014 Hz, což ve vakuu odpovídá vlnovým délkám v rozmezí 380–740 nm.