Izotop je označení pro konkrétní nuklid ze souboru nuklidů jednoho chemického prvku. Jádra atomů izotopů jednoho prvku mají stejný počet protonů, ale mohou mít rozdílný počet neutronů. Mají tedy stejné atomové číslo a rozdílné hmotové číslo a atomovou hmotnost.NUKLID – je látka složená pouze z atomů, které mají určitý stejný počet protonů a určitý stejný počet neutronů. Zápis nuklidů: IZOTOPY (= IZOTOPICKÉ NUKLIDY) – jsou látky složené z atomů se stejným protonovým číslem s různým nukleonovým číslem.Atomy různých prvků se liší svým atomovým číslem, které vyjadřuje počet protonů v jádře (např. atom se šesti protony je atomem uhlíku; počet elektronů v obalu je u běžného elektricky neutrálního atomu shodný s počtem protonů v jádře). Atomy jednoho prvku se mohou lišit počtem neutronů v jádře (tzv.
Jak poznat izotop : Atomy, které mají stejný počet protonů, ale liší se v počtu neutronů, se nazývají izotopy. Izotopy daného prvku se liší atomovou hmotností. Relativní zastoupení izotopu říká, kolik procent atomů s danou atomovou hmotností se nachází v přirozeně se vyskytujícím vzorku prvku.
Jak vznika izotop
Přírodní izotopy
C je vytvářen tepelnými neutrony z kosmického záření ve vyšších vrstvách atmosféry, odkud se dostává k zemskému povrchu a je absorbován živými organismy. Jelikož je radioaktivní s poločasem 5700 let, je radiometricky detekovatelný.
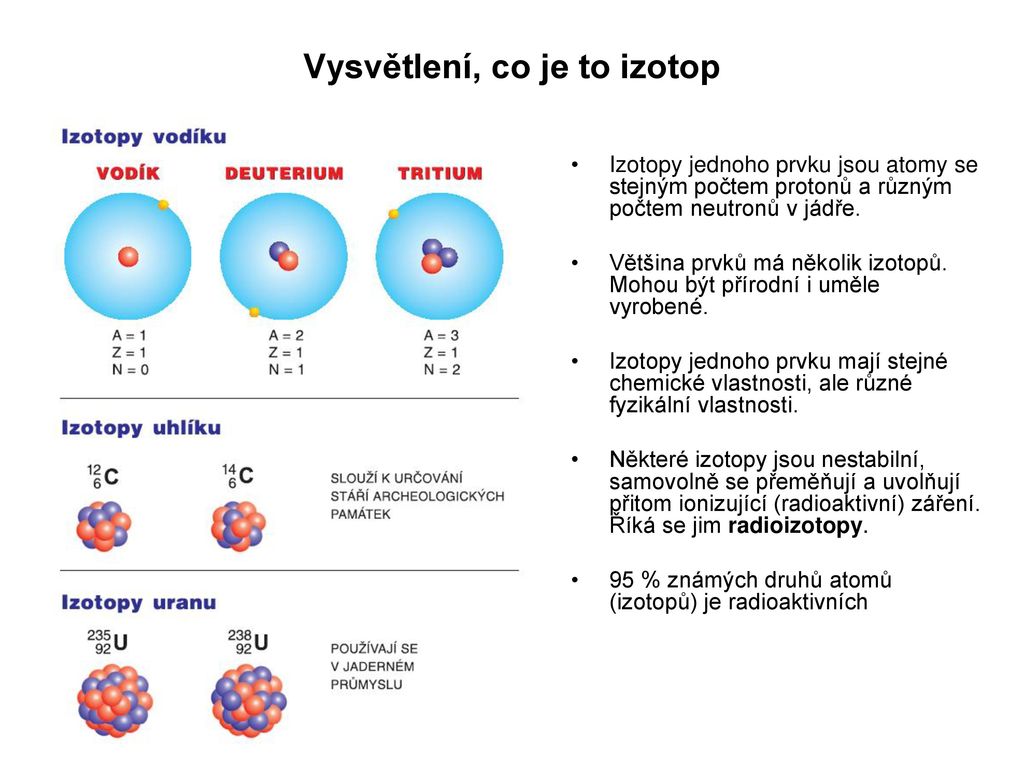
Jaké jsou izotopy vodíku : Atom vodíku 1H je nejjednodušším atomem periodického systému tvořený jedním protonem a jedním elektronem. Je prvkem s-bloku, kde spolu s heliem představují jediné dva nekovové prvky. Vedle 1H má dva další izotopy – deuterium 2H resp. D a tritium 3H resp.
Když hovořím o nuklidu 238U, tak mám na mysli daný prvek s příslušným počtem neutronů. Jiný nuklid je např. U. Tyto dva nuklidy náleží stejnému prvku, liší se jen počtem neutronů, a říkáme jim izotopy. Izoton je označení dvojice různých atomů, které mají v jádru rozdílný počet protonů (rozdílné protonové číslo), ale stejný počet neutronů (stejné neutronové číslo). Například 12B a 13C jsou izotony, protože počet protonů v boru je 5 a v uhlíku 6, ale počet neutronů mají oba stejný: 7.
Co je menší než atom
Hadron je složená silně interagující subatomární částice (menší než atom). Hadrony mohou obsahovat kvarky, antikvarky, případně také gluony nebo být složeny pouze z gluonů.Každý atom se skládá z atomového obalu a jádra. Obal je tvořen určitým počtem záporných elektronů, které si (velmi zjednodušeně) můžeme představit jako nepatrné kuličky „obíhající“ kolem kladného jádra. Jádro je složeno ze dvou druhů částic – kladně nabitých protonů a elektricky neutrálních neutronů.1/ VODÍK – ZÁKLAD VESMÍRU
Jádrem vodíkového atomu je proton, obal tvoří jediný elektron. V záporném iontu vodíku (H–) jsou elektrony dva. Vodík má pět izotopů, z nichž nejznámější jsou prvé tři. Izotopy se označují exponentem vlevo nahoře u symbolu H, např.
chemický prvek – látka, jejíž atomy mají v jádře stejný počet Z protonů.
nuklid – látka, jejíž atomy mají jádra se shodným složením, všechna tedy mají stejné protonové číslo Z a stejné nukleonové číslo A – nuklid je tvořen jediným izotopem.
Co je to Izobar : V meteorologii je izobara čára (izolinie) spojující na mapě místa se stejným tlakem vzduchu přepočteným na hladinu moře. Izobary jsou čáry, které se nikdy neprotínají. Mohou být uzavřené, pak se jedná o tlakovou níži (cyklónu) nebo výši (anticyklónu).
Co je nejtěžší v atomu : Atom se skládá z atomového jádra a elektronového obalu. Jádro je proti obalu velice malé a je v něm soustředěno téměř 99 % hmotnosti celého atomu.
Co má atomové číslo 1
S protonovým číslem souvisejí tyto termíny: Tři izotopy vodíku s protonovým číslem 1: * Protium obsahuje jeden proton a jeden elektron * Deuterium jeden proton, jeden neutron a jeden elektron * Tritium jeden proton, dva neutrony a jeden elektron Neutronové číslo (N) – je počet neutronů v jádře atomu. Základy moderní atomové teorie, teď už na vědeckém základě, položil anglický chemik John Dalton. V jeho pojetí byly atomy základními nedělitelnými částicemi látek, které se ještě mohou účastnit chemických reakcí.Vodík (H) má tři přírodní izotopy označované 1H, 2H a 3H. První dva jsou stabilní, 3H má poločas přeměny 12,32 let. Všechny těžší izotopy byly připraveny uměle a mají poločas kratší než 1 zeptosekunda (10−21 s).
Jaké má izotopy vodík : Atom vodíku 1H je nejjednodušším atomem periodického systému tvořený jedním protonem a jedním elektronem. Je prvkem s-bloku, kde spolu s heliem představují jediné dva nekovové prvky. Vedle 1H má dva další izotopy – deuterium 2H resp. D a tritium 3H resp.
Antwort Co jsou to izotopy a čím se liší? Weitere Antworten – Co to je izotop
Izotop je označení pro konkrétní nuklid ze souboru nuklidů jednoho chemického prvku. Jádra atomů izotopů jednoho prvku mají stejný počet protonů, ale mohou mít rozdílný počet neutronů. Mají tedy stejné atomové číslo a rozdílné hmotové číslo a atomovou hmotnost.NUKLID – je látka složená pouze z atomů, které mají určitý stejný počet protonů a určitý stejný počet neutronů. Zápis nuklidů: IZOTOPY (= IZOTOPICKÉ NUKLIDY) – jsou látky složené z atomů se stejným protonovým číslem s různým nukleonovým číslem.Atomy různých prvků se liší svým atomovým číslem, které vyjadřuje počet protonů v jádře (např. atom se šesti protony je atomem uhlíku; počet elektronů v obalu je u běžného elektricky neutrálního atomu shodný s počtem protonů v jádře). Atomy jednoho prvku se mohou lišit počtem neutronů v jádře (tzv.
Jak poznat izotop : Atomy, které mají stejný počet protonů, ale liší se v počtu neutronů, se nazývají izotopy. Izotopy daného prvku se liší atomovou hmotností. Relativní zastoupení izotopu říká, kolik procent atomů s danou atomovou hmotností se nachází v přirozeně se vyskytujícím vzorku prvku.
Jak vznika izotop
Přírodní izotopy
C je vytvářen tepelnými neutrony z kosmického záření ve vyšších vrstvách atmosféry, odkud se dostává k zemskému povrchu a je absorbován živými organismy. Jelikož je radioaktivní s poločasem 5700 let, je radiometricky detekovatelný.
Jaké jsou izotopy vodíku : Atom vodíku 1H je nejjednodušším atomem periodického systému tvořený jedním protonem a jedním elektronem. Je prvkem s-bloku, kde spolu s heliem představují jediné dva nekovové prvky. Vedle 1H má dva další izotopy – deuterium 2H resp. D a tritium 3H resp.
Když hovořím o nuklidu 238U, tak mám na mysli daný prvek s příslušným počtem neutronů. Jiný nuklid je např. U. Tyto dva nuklidy náleží stejnému prvku, liší se jen počtem neutronů, a říkáme jim izotopy.
Izoton je označení dvojice různých atomů, které mají v jádru rozdílný počet protonů (rozdílné protonové číslo), ale stejný počet neutronů (stejné neutronové číslo). Například 12B a 13C jsou izotony, protože počet protonů v boru je 5 a v uhlíku 6, ale počet neutronů mají oba stejný: 7.
Co je menší než atom
Hadron je složená silně interagující subatomární částice (menší než atom). Hadrony mohou obsahovat kvarky, antikvarky, případně také gluony nebo být složeny pouze z gluonů.Každý atom se skládá z atomového obalu a jádra. Obal je tvořen určitým počtem záporných elektronů, které si (velmi zjednodušeně) můžeme představit jako nepatrné kuličky „obíhající“ kolem kladného jádra. Jádro je složeno ze dvou druhů částic – kladně nabitých protonů a elektricky neutrálních neutronů.1/ VODÍK – ZÁKLAD VESMÍRU
Jádrem vodíkového atomu je proton, obal tvoří jediný elektron. V záporném iontu vodíku (H–) jsou elektrony dva. Vodík má pět izotopů, z nichž nejznámější jsou prvé tři. Izotopy se označují exponentem vlevo nahoře u symbolu H, např.

Co je to Izobar : V meteorologii je izobara čára (izolinie) spojující na mapě místa se stejným tlakem vzduchu přepočteným na hladinu moře. Izobary jsou čáry, které se nikdy neprotínají. Mohou být uzavřené, pak se jedná o tlakovou níži (cyklónu) nebo výši (anticyklónu).
Co je nejtěžší v atomu : Atom se skládá z atomového jádra a elektronového obalu. Jádro je proti obalu velice malé a je v něm soustředěno téměř 99 % hmotnosti celého atomu.
Co má atomové číslo 1
S protonovým číslem souvisejí tyto termíny: Tři izotopy vodíku s protonovým číslem 1: * Protium obsahuje jeden proton a jeden elektron * Deuterium jeden proton, jeden neutron a jeden elektron * Tritium jeden proton, dva neutrony a jeden elektron Neutronové číslo (N) – je počet neutronů v jádře atomu.

Základy moderní atomové teorie, teď už na vědeckém základě, položil anglický chemik John Dalton. V jeho pojetí byly atomy základními nedělitelnými částicemi látek, které se ještě mohou účastnit chemických reakcí.Vodík (H) má tři přírodní izotopy označované 1H, 2H a 3H. První dva jsou stabilní, 3H má poločas přeměny 12,32 let. Všechny těžší izotopy byly připraveny uměle a mají poločas kratší než 1 zeptosekunda (10−21 s).
Jaké má izotopy vodík : Atom vodíku 1H je nejjednodušším atomem periodického systému tvořený jedním protonem a jedním elektronem. Je prvkem s-bloku, kde spolu s heliem představují jediné dva nekovové prvky. Vedle 1H má dva další izotopy – deuterium 2H resp. D a tritium 3H resp.