Brom je červenohnědá kapalina. Je to jeden ze dvou prvků PSP a jediný nekov, který je kapalný za laboratorní teploty (teplota tání je -7,2°C). Brom je málo rozpustný ve vodě, ale velmi dobře rozpustný např. v CCl4, CS2 nebo methanolu.Fyzikální vlastnosti bromu
Brom má 35 protonů, tudíž jeho elektronový obal se musí skládat z 35 elektronů.V zápisu zkrácené elektronové konfigurace pomocí kvantových čísel je vidět, že brom má sedm valenčních elektronů (4s 2 4p 5, 2 + 5 = 7 ), lze vyčíst i z rámečkového diagramu (obsahuje 7 šipek).
Jak se značí brom : Brom je chemický prvek s protonovým číslem 35 a je třetím členem 17. (VII. A) skupiny periodické soustavy, tedy skupiny halogenů. Má značku Br z latinského názvu Bromum.
Kde se nachází brom
V přírodě je brom zastoupen dvěma stálými izotopy s přibližně stejným zastoupením: 79Br a 81Br. Obsah "bromu" v zemské kůře je malý. Mnokem více "bromu" najdeme v mořské vodě, odkud se také brom získává. Brom se v přírodě díky své velké reaktivitě v přírodě nevyskytuje v elementárním stavu, ale pouze ve sloučeninách.
Jak se řekne latinsky brom : Brom je chemický prvek s protonovým číslem 35 a je třetím členem 17. (VII. A) skupiny periodické soustavy, tedy skupiny halogenů. Má značku Br z latinského názvu Bromum.
Obecně platí, že počet valenčních elektronů je stejný jako číslo sloupce a roste v rámci řádku zleva doprava. Prvky skupiny 1 mají jeden valenční elektron a prvky skupiny 18 mají osm valenčních elektronů až na helium, které má celkem pouze dva elektrony. Sloučeniny bromu se dnes široce využívají především při výrobě zpomalovačů hoření a hasicích přístrojů, ve fotografickém průmyslu, při výrobě pesticidů, dezinfekčních činidel nebo slzotvorných prostředků. Sloučeniny bromu, především kyselinu bromovodíkovou a nejrůznější barviva, využívá také chemický průmysl.
Co způsobuje brom
Elementární brom je jedovatý a způsobuje těžké, špatně se hojící popáleniny. Výpary dráždí sliznice. Nadměrný příjem bromu vede k depresím a hubnutí. Kyselina bromovodíková je velice silná kyselina, která může způsobit vážné poleptání.Sloučeniny bromu se dnes široce využívají především při výrobě zpomalovačů hoření a hasicích přístrojů, ve fotografickém průmyslu, při výrobě pesticidů, dezinfekčních činidel nebo slzotvorných prostředků. Sloučeniny bromu, především kyselinu bromovodíkovou a nejrůznější barviva, využívá také chemický průmysl.Sloučeniny bromu se dnes široce využívají především při výrobě zpomalovačů hoření a hasicích přístrojů, ve fotografickém průmyslu, při výrobě pesticidů, dezinfekčních činidel nebo slzotvorných prostředků. Sloučeniny bromu, především kyselinu bromovodíkovou a nejrůznější barviva, využívá také chemický průmysl. Počet elektronů je stejný jako počet protonů. Atom, který má v jádru pět protonů, má v atomovém obalu 5 elektronů. Prvek, který má v jádru pět protonů se nazývá BOR a má značku B. Prvek, který má v jádru osm protonů se nazývá KYSLÍK a má značku O.
Kolik elektronů je ve valenční vrstvě : Chemická vazba. Zaplněná valenční slupka má osm elektronů. Tento stav se nazývá elektronový oktet. V periodické tabulce prvků objevené D. I.
V čem se nachází brom : Hlavní zdroje bromu v potravinách. Nejvíce ho obsahují mořské plody a houby (až 250 μg na 100 g), méně naopak mléčné produkty, maso a vnitřnosti (5 až 10 μg na 100 g). U obilovin, luštěnin a ořechů se množství pohybuje okolo 80 μg na 100 g potraviny. V případě rostlin jsou nejlepším zdrojem zelené listy.
Na co se používá brom
Sloučeniny bromu se dnes široce využívají především při výrobě zpomalovačů hoření a hasicích přístrojů, ve fotografickém průmyslu, při výrobě pesticidů, dezinfekčních činidel nebo slzotvorných prostředků. Sloučeniny bromu, především kyselinu bromovodíkovou a nejrůznější barviva, využívá také chemický průmysl. Elementární brom je jedovatý a způsobuje těžké, špatně se hojící popáleniny. Výpary dráždí sliznice. Nadměrný příjem bromu vede k depresím a hubnutí. Kyselina bromovodíková je velice silná kyselina, která může způsobit vážné poleptání.Protonové číslo kyslíku je 8, a proto jádro atomu kyslíku obsahuje 8 protonů, elektronový obal 8 elektronů.
Který prvek má 12 protonů : Seznam všech objevených prvků
Antwort Co je za prvek Br? Weitere Antworten – Co to je brom
Brom je červenohnědá kapalina. Je to jeden ze dvou prvků PSP a jediný nekov, který je kapalný za laboratorní teploty (teplota tání je -7,2°C). Brom je málo rozpustný ve vodě, ale velmi dobře rozpustný např. v CCl4, CS2 nebo methanolu.Fyzikální vlastnosti bromu
Brom má 35 protonů, tudíž jeho elektronový obal se musí skládat z 35 elektronů.V zápisu zkrácené elektronové konfigurace pomocí kvantových čísel je vidět, že brom má sedm valenčních elektronů (4s 2 4p 5, 2 + 5 = 7 ), lze vyčíst i z rámečkového diagramu (obsahuje 7 šipek).

Jak se značí brom : Brom je chemický prvek s protonovým číslem 35 a je třetím členem 17. (VII. A) skupiny periodické soustavy, tedy skupiny halogenů. Má značku Br z latinského názvu Bromum.
Kde se nachází brom
V přírodě je brom zastoupen dvěma stálými izotopy s přibližně stejným zastoupením: 79Br a 81Br. Obsah "bromu" v zemské kůře je malý. Mnokem více "bromu" najdeme v mořské vodě, odkud se také brom získává. Brom se v přírodě díky své velké reaktivitě v přírodě nevyskytuje v elementárním stavu, ale pouze ve sloučeninách.
Jak se řekne latinsky brom : Brom je chemický prvek s protonovým číslem 35 a je třetím členem 17. (VII. A) skupiny periodické soustavy, tedy skupiny halogenů. Má značku Br z latinského názvu Bromum.
Obecně platí, že počet valenčních elektronů je stejný jako číslo sloupce a roste v rámci řádku zleva doprava. Prvky skupiny 1 mají jeden valenční elektron a prvky skupiny 18 mají osm valenčních elektronů až na helium, které má celkem pouze dva elektrony.
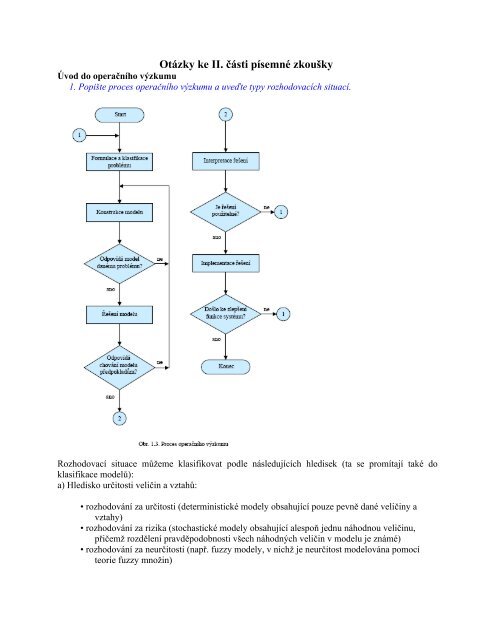
Sloučeniny bromu se dnes široce využívají především při výrobě zpomalovačů hoření a hasicích přístrojů, ve fotografickém průmyslu, při výrobě pesticidů, dezinfekčních činidel nebo slzotvorných prostředků. Sloučeniny bromu, především kyselinu bromovodíkovou a nejrůznější barviva, využívá také chemický průmysl.
Co způsobuje brom
Elementární brom je jedovatý a způsobuje těžké, špatně se hojící popáleniny. Výpary dráždí sliznice. Nadměrný příjem bromu vede k depresím a hubnutí. Kyselina bromovodíková je velice silná kyselina, která může způsobit vážné poleptání.Sloučeniny bromu se dnes široce využívají především při výrobě zpomalovačů hoření a hasicích přístrojů, ve fotografickém průmyslu, při výrobě pesticidů, dezinfekčních činidel nebo slzotvorných prostředků. Sloučeniny bromu, především kyselinu bromovodíkovou a nejrůznější barviva, využívá také chemický průmysl.Sloučeniny bromu se dnes široce využívají především při výrobě zpomalovačů hoření a hasicích přístrojů, ve fotografickém průmyslu, při výrobě pesticidů, dezinfekčních činidel nebo slzotvorných prostředků. Sloučeniny bromu, především kyselinu bromovodíkovou a nejrůznější barviva, využívá také chemický průmysl.

Počet elektronů je stejný jako počet protonů. Atom, který má v jádru pět protonů, má v atomovém obalu 5 elektronů. Prvek, který má v jádru pět protonů se nazývá BOR a má značku B. Prvek, který má v jádru osm protonů se nazývá KYSLÍK a má značku O.
Kolik elektronů je ve valenční vrstvě : Chemická vazba. Zaplněná valenční slupka má osm elektronů. Tento stav se nazývá elektronový oktet. V periodické tabulce prvků objevené D. I.
V čem se nachází brom : Hlavní zdroje bromu v potravinách. Nejvíce ho obsahují mořské plody a houby (až 250 μg na 100 g), méně naopak mléčné produkty, maso a vnitřnosti (5 až 10 μg na 100 g). U obilovin, luštěnin a ořechů se množství pohybuje okolo 80 μg na 100 g potraviny. V případě rostlin jsou nejlepším zdrojem zelené listy.
Na co se používá brom
Sloučeniny bromu se dnes široce využívají především při výrobě zpomalovačů hoření a hasicích přístrojů, ve fotografickém průmyslu, při výrobě pesticidů, dezinfekčních činidel nebo slzotvorných prostředků. Sloučeniny bromu, především kyselinu bromovodíkovou a nejrůznější barviva, využívá také chemický průmysl.

Elementární brom je jedovatý a způsobuje těžké, špatně se hojící popáleniny. Výpary dráždí sliznice. Nadměrný příjem bromu vede k depresím a hubnutí. Kyselina bromovodíková je velice silná kyselina, která může způsobit vážné poleptání.Protonové číslo kyslíku je 8, a proto jádro atomu kyslíku obsahuje 8 protonů, elektronový obal 8 elektronů.
Který prvek má 12 protonů : Seznam všech objevených prvků