Redoxní rovnici můžeme vyčíslit pomocí tohoto postupu: 1) Zapíšeme poloreakce. 2) Obě poloreakce vyčíslíme tak, aby na obou stranách byl stejný počet atomů přítomných prvků, a zapíšeme, kolik elektronů přibyde nebo ubyde.Redoxní reakce poznáme podle toho, že při nich dochází ke změně oxidačních čísel reaktantů. Redoxní reakce můžeme rozdělit na dvě dílčí poloreakce příslušející oxidaci a redukci. Při vyčíslování redoxních rovnic musíme dbát nejen na bilanci prvků, ale i na bilanci náboje, k tomu nám může pomoci metoda poloreakcí.Redoxní reakce (také oxidačně-redukční reakce) jsou chemické reakce, při kterých se mění oxidační čísla atomů. Každá redoxní reakce je tvořena dvěma poloreakcemi, které probíhají současně. Tyto dvě poloreakce jsou oxidace a redukce. Redoxní reakcí je i hoření Koroze je redoxní reakce s nepříjemnými dopady pro průmysl.
Co se děje při Redoxních reakcích : Oxidačně redukční neboli redoxní reakce jsou všechny chemické reakce, u nichž dochází k přenosu elektronů mezi reagujícími částicemi. oxidační číslo atomu mědi se snížilo = redukce U aniontu (SO4)-II se oxidační číslo nezměnilo. Počet přijatých a odevzdaných elektronů je stejný.
Co je to redoxní rovnice
Chemická rovnice popisuje průběh chemického děje, při němž ze vstupních látek (reaktantů) vznikají nové látky (produkty). Pokud při chemické reakci dochází ke změně oxidačních čísel některých (nebo i všech) atomů, označujeme takovou reakci jako oxidačně-redukční (zkráceně redoxní) reakci.
Jak se počítá oxidační číslo : Oxidační číslo píšeme římskou číslicí, znaménko „plus/mínus“ píšeme před číslici (např. +II; –IV), kladné oxidační stavy se někdy píšou i bez znaménka plus. Arabské číslice používáme pro vyjádření náboje jednoatomových nebo víceatomových iontů.
Oxidačně-redukční (redox) potenciál je složený parametr celkové intenzity oxidačních nebo redukčních podmínek v systému a odráží stupeň vyváženosti mezi oxidačními a redukčními procesy.
oxidační činidlo – je taková látka, která má schopnost přijímat elektrony (redukovat se), jiné látky oxiduje.
redukční činidlo – látka, která může elektrony poskytovat (oxidovat se), jiné látky redukuje.
Co vznika při oxidaci
Oxidace znamená ztrátu jednoho nebo více elektronů (vzroste oxidační číslo atomu/iontu, který byl zoxidován). Redukce je pak přijetí jednoho nebo více elektronů a snížení oxidačního čísla.Rovnice je v matematice vztah rovnosti dvou výrazů, které obsahují jednu nebo více proměnných. Kořen rovnice je libovolná hodnota proměnné (příp. sada hodnot proměnných), pro které je rovnost splněna.Co jsou oxidační čísla Chemici používají oxidační čísla (nebo oxidační stavy či stupně) ke sledování toho, kolik elektronů přísluší danému atomu. Oxidační čísla vždy neodpovídají skutečným nábojům v molekulách a určujeme je pro atomy, které se podílejí na kovalentních (a také iontových) vazbách.
Oxidační číslo (oxidační stav, oxidační stupeň nebo také mocenství) je elektrický náboj, který by se nacházel na atomu prvku, kdybychom elektrony v každé vazbě, které vycházejí z daného atomu, přidělili atomu s vyšší elektronegativitou.
Co to je oxidace a redukce : Oxidace je děj, při kterém dochází ke zvyšování oxidačního čísla prvku. Oxidovaný prvek odevzdává elektrony jinému atomu. Redukce je děj, při kterém dochází ke snižování oxidačního čísla prvku. Redukovaný prvek přijímá elektrony od jiného atomu.
Jak zvysit Redox : 3) Další možností je zvýšit redox potenciál pomocí nějakého silného oxidačního činidla, např. manganistanu draselného nebo peroxo sloučenin. Manganistan draselný má ovšem tu nevýhodu, že vodu zabarvuje do červenofialova a tak, jak postupně oxiduje přítomné nečistoty, přechází toto zabarvení do červenohněda.
Co jsou to oxidační činidla
Oxidační činidlo je látka, která přijímá elektrony od jiné látky, oxiduje ji a sama sebe redukuje. Mezi nejsilnější oxidační činidla patří prvky z pravé horní části periodické tabulky (například: fluor, kyslík, chlor) a některé sloučeniny (anorg. kyseliny, manganistany, peroxidy) a některé druhy molekul prvků (ozon).
Oxidační číslo píšeme římskou číslicí, znaménko „plus/mínus“ píšeme před číslici (např. +II; –IV), kladné oxidační stavy se někdy píšou i bez znaménka plus. Arabské číslice používáme pro vyjádření náboje jednoatomových nebo víceatomových iontů.Binární (dvouprvkové) sloučeniny kyslíku s dalším prvkem se nazývají oxidy. Dříve se používal název kysličník. Oxidy obsahují ve své molekule oxidový anion O2-. Oxidy vznikají odtržením 2 atomů vodíku z vody (H2O).
Jak se zapisuji rovnice : Kvadratickou rovnici s neznámou x lze psát ve tvaru a x 2 + b x + c = 0 , kde a , b , c jsou reálná čísla, a ≠ 0 . Tento tvar se nazývá obecný tvar kvadratické rovnice.
Antwort Co je redoxní rovnice? Weitere Antworten – Jak se počítají redoxní rovnice
Redoxní rovnici můžeme vyčíslit pomocí tohoto postupu: 1) Zapíšeme poloreakce. 2) Obě poloreakce vyčíslíme tak, aby na obou stranách byl stejný počet atomů přítomných prvků, a zapíšeme, kolik elektronů přibyde nebo ubyde.Redoxní reakce poznáme podle toho, že při nich dochází ke změně oxidačních čísel reaktantů. Redoxní reakce můžeme rozdělit na dvě dílčí poloreakce příslušející oxidaci a redukci. Při vyčíslování redoxních rovnic musíme dbát nejen na bilanci prvků, ale i na bilanci náboje, k tomu nám může pomoci metoda poloreakcí.Redoxní reakce (také oxidačně-redukční reakce) jsou chemické reakce, při kterých se mění oxidační čísla atomů. Každá redoxní reakce je tvořena dvěma poloreakcemi, které probíhají současně. Tyto dvě poloreakce jsou oxidace a redukce. Redoxní reakcí je i hoření Koroze je redoxní reakce s nepříjemnými dopady pro průmysl.
Co se děje při Redoxních reakcích : Oxidačně redukční neboli redoxní reakce jsou všechny chemické reakce, u nichž dochází k přenosu elektronů mezi reagujícími částicemi. oxidační číslo atomu mědi se snížilo = redukce U aniontu (SO4)-II se oxidační číslo nezměnilo. Počet přijatých a odevzdaných elektronů je stejný.
Co je to redoxní rovnice
Chemická rovnice popisuje průběh chemického děje, při němž ze vstupních látek (reaktantů) vznikají nové látky (produkty). Pokud při chemické reakci dochází ke změně oxidačních čísel některých (nebo i všech) atomů, označujeme takovou reakci jako oxidačně-redukční (zkráceně redoxní) reakci.
Jak se počítá oxidační číslo : Oxidační číslo píšeme římskou číslicí, znaménko „plus/mínus“ píšeme před číslici (např. +II; –IV), kladné oxidační stavy se někdy píšou i bez znaménka plus. Arabské číslice používáme pro vyjádření náboje jednoatomových nebo víceatomových iontů.
Oxidačně-redukční (redox) potenciál je složený parametr celkové intenzity oxidačních nebo redukčních podmínek v systému a odráží stupeň vyváženosti mezi oxidačními a redukčními procesy.

Co vznika při oxidaci
Oxidace znamená ztrátu jednoho nebo více elektronů (vzroste oxidační číslo atomu/iontu, který byl zoxidován). Redukce je pak přijetí jednoho nebo více elektronů a snížení oxidačního čísla.Rovnice je v matematice vztah rovnosti dvou výrazů, které obsahují jednu nebo více proměnných. Kořen rovnice je libovolná hodnota proměnné (příp. sada hodnot proměnných), pro které je rovnost splněna.Co jsou oxidační čísla Chemici používají oxidační čísla (nebo oxidační stavy či stupně) ke sledování toho, kolik elektronů přísluší danému atomu. Oxidační čísla vždy neodpovídají skutečným nábojům v molekulách a určujeme je pro atomy, které se podílejí na kovalentních (a také iontových) vazbách.

Oxidační číslo (oxidační stav, oxidační stupeň nebo také mocenství) je elektrický náboj, který by se nacházel na atomu prvku, kdybychom elektrony v každé vazbě, které vycházejí z daného atomu, přidělili atomu s vyšší elektronegativitou.
Co to je oxidace a redukce : Oxidace je děj, při kterém dochází ke zvyšování oxidačního čísla prvku. Oxidovaný prvek odevzdává elektrony jinému atomu. Redukce je děj, při kterém dochází ke snižování oxidačního čísla prvku. Redukovaný prvek přijímá elektrony od jiného atomu.
Jak zvysit Redox : 3) Další možností je zvýšit redox potenciál pomocí nějakého silného oxidačního činidla, např. manganistanu draselného nebo peroxo sloučenin. Manganistan draselný má ovšem tu nevýhodu, že vodu zabarvuje do červenofialova a tak, jak postupně oxiduje přítomné nečistoty, přechází toto zabarvení do červenohněda.
Co jsou to oxidační činidla
Oxidační činidlo je látka, která přijímá elektrony od jiné látky, oxiduje ji a sama sebe redukuje. Mezi nejsilnější oxidační činidla patří prvky z pravé horní části periodické tabulky (například: fluor, kyslík, chlor) a některé sloučeniny (anorg. kyseliny, manganistany, peroxidy) a některé druhy molekul prvků (ozon).
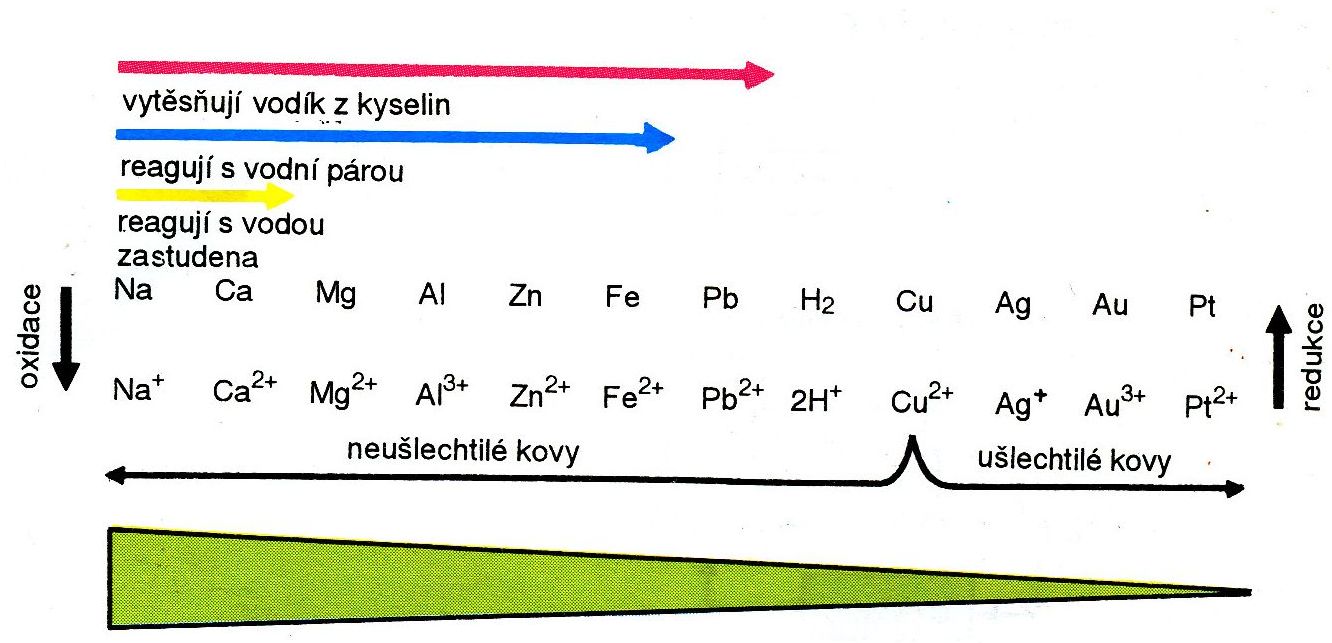
Oxidační číslo píšeme římskou číslicí, znaménko „plus/mínus“ píšeme před číslici (např. +II; –IV), kladné oxidační stavy se někdy píšou i bez znaménka plus. Arabské číslice používáme pro vyjádření náboje jednoatomových nebo víceatomových iontů.Binární (dvouprvkové) sloučeniny kyslíku s dalším prvkem se nazývají oxidy. Dříve se používal název kysličník. Oxidy obsahují ve své molekule oxidový anion O2-. Oxidy vznikají odtržením 2 atomů vodíku z vody (H2O).
Jak se zapisuji rovnice : Kvadratickou rovnici s neznámou x lze psát ve tvaru a x 2 + b x + c = 0 , kde a , b , c jsou reálná čísla, a ≠ 0 . Tento tvar se nazývá obecný tvar kvadratické rovnice.