Reakční mechanismus je sled elementárních reakčních kroků, ze kterých se skládá chemická reakce. U každého kroku chemické reakce mechanismus popisuje strukturu a stereochemii přechodného stavu i produktu, podává informace o tom, které vazby se štěpí a které vznikají.Reakce představuje odezvu na určitou událost. Může být: chemie (obecná)Rozkladné reakce (analýzy) probíhají tak, že složitější molekuly reaktantů se štěpí na jedno- dušší částice produktů. Rozkladné reakce probíhají např. při žíhání látek, přípravě některých plynů, krakování uhlovodíků nebo při trávení živin. Rozkladné reakce probíhají také při explozi některých výbušnin.
Jaké jsou typy chemických reakcí : Chemické reakce lze klasifikovat podle různých kritérií, včetně fyzikálního stavu substrátů a produktů nebo energetického účinku. Nejčastěji se však dělí podle typu a počtu složek, které se na nich podílejí a podle toho rozlišujeme reakce syntézní, rozkladné a vytěsňovací.
Co je to Reaktant
Reaktant je látka nebo látky, které vstupují do chemické reakce a mění se na produkt nebo produkty. Během reakce se reaktanty spotřebovávají. Reaktantem mohou být prvky nebo chemické sloučeniny. V biochemii, zejména v souvislosti s enzymatickými reakcemi, se reaktanty běžně nazývají substráty.
Čím se zabývá reakční kinetika : se zabývá rychlostí chemických reakcí.
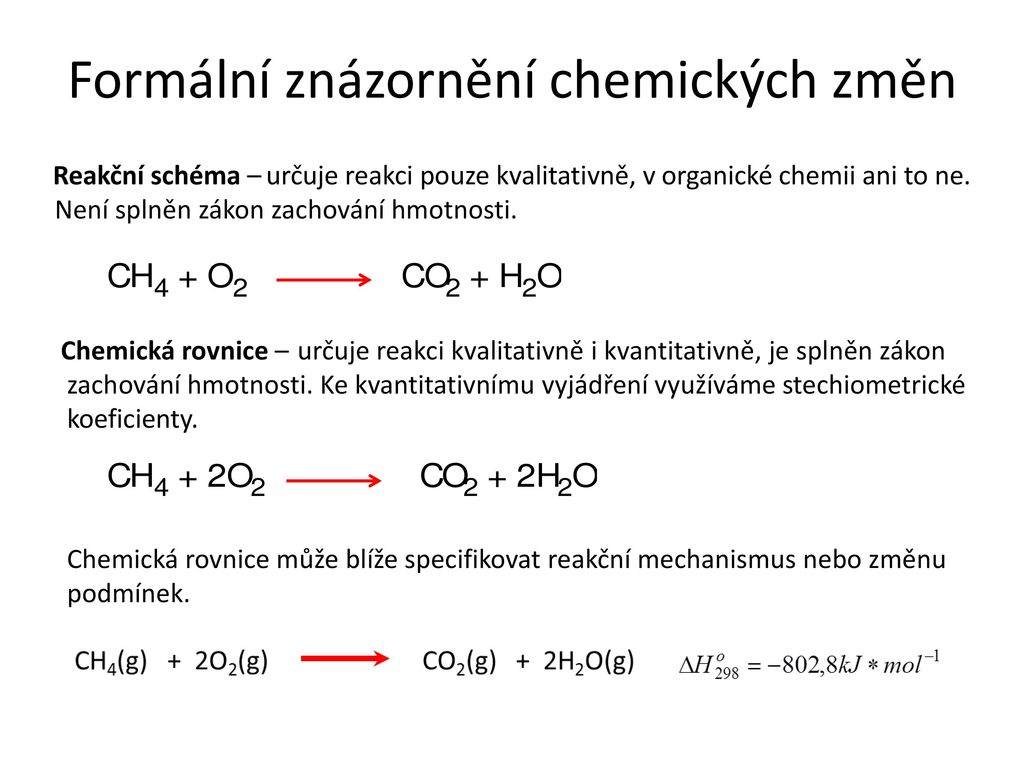
Látky, které do reakce vstupují, nazýváme reaktanty. Látky, které z reakce vystupují, nazýváme produkty. Při tomto procesu dochází ke změnám v rozmístění elektronové hustoty v molekule, zjednodušeně řečeno, dochází k zániku a vzniku chemických vazeb. Chemické reakce popisujeme pomocí chemických rovnic. Methyl (methylová skupina) je hydrofobní alkylovou funkční skupinou. Methyl vzniká odtržením jednoho vodíkového atomu z methanu. Má souhrnný vzorec -CH3. Někdy se ve vzorcích označuje jako Me.
Co to je reakční teplo
Reakční teplo se vyjadřuje pomocí veličiny enthalpie. Je to teplo, které soustava přijme či uvolní za stálého tlaku a teploty při jednotkovém látkovém rozsahu reakce. Absolutní hodnotu nelze změřit, lze pouze stanovit změnu enthalpie ΔH, která je vyjadřována za standardních podmínek (t = 25 °C, p = 101,325 kPa).Typy reakcí
přímá – vznik produktů
zpětná – reakce produktů za vzniku výchozích látek.
vratná – přímá a zpětná reakce probíhají vzájemně
Termochemie se zabývá studiem tepelného zabarvení chemických reakcí. Dle tepelného zabarvení dělíme reakce na exotermní (teplo se uvolňuje) a endotermní (teplo se spotřebovává). V termochemické rovnici se uvádí symboly skupenství u prvků či sloučenin, protože hodnoty reakčního tepla závisí i na skupenství. Chemická vazba
2.1 Kovová vazba.
2.2 Kovalentní vazba.
2.3 Iontová vazba.
Co je to Presmyk : Přesmyk je stavba (vedení kolejí) umožňující přejezd vlaků mezi kolejemi/tratěmi bez narušení jízdy vlaků jedoucích po jiné koleji.
Jaká je reakční doba : Celková reakční doba pak závisí na úhlu zaměření pohledu a pohybuje se od zhruba 0,4 do 1,5 s. Průměrná reakční doba přes pedál je 1,2 s a přes volant 0,9 s. U trénovaných řidičů může být nižší a naopak u rozptylovaných řidičů vyšší. Rozptylovat může telefonování, psaní zpráv, hudba a jiné příčiny.
Co je to CH2
Ethen (triviální názvy: ethylen, etylén) je nejjednodušším zástupcem uhlovodíků ze skupiny alkenů. Je to bezbarvý hořlavý plyn nasládlé vůně s teplotou tání −169,1 °C. Se vzduchem tvoří výbušnou směs. Bývá obsažen v zemním a koksárenském plynu, dále se získává krakováním. CH2/CH3 je sklápěcí vanová zástěna, jež je důkladně technickypropracována a díky tomu ji lze pohodlně sklápět. Vybírat můžete z dvoudílného provedení – CH2 či trojdílného provedení – CH3.Reakční teplo ze spalných tepel se vypočítá jako součet spalných tepel reaktantů (vynásobených stechiometrickými koeficienty), od kterých jsou odečtena spalná tepla produktů (též vynásobená příslušnými koeficienty). Reakční teplo reakce je -52 kJ⋅mol−1.
Jak se značí reakční teplo : Reakční teplo se vyjadřuje pomocí veličiny enthalpie. Vyjadřuje teplo, které soustava přijme či uvolní za stálého tlaku v rozsahu jednoho molu. Absolutní hodnotu nelze změřit, lze pouze stanovit změnu enthalpie ΔH, která je vyjadřována za standardních podmínek (t = 25 °C, p = 101,325 kPa).
Antwort Co je reakční schéma? Weitere Antworten – Co je to reakční mechanismus
Reakční mechanismus je sled elementárních reakčních kroků, ze kterých se skládá chemická reakce. U každého kroku chemické reakce mechanismus popisuje strukturu a stereochemii přechodného stavu i produktu, podává informace o tom, které vazby se štěpí a které vznikají.Reakce představuje odezvu na určitou událost. Může být: chemie (obecná)Rozkladné reakce (analýzy) probíhají tak, že složitější molekuly reaktantů se štěpí na jedno- dušší částice produktů. Rozkladné reakce probíhají např. při žíhání látek, přípravě některých plynů, krakování uhlovodíků nebo při trávení živin. Rozkladné reakce probíhají také při explozi některých výbušnin.
Jaké jsou typy chemických reakcí : Chemické reakce lze klasifikovat podle různých kritérií, včetně fyzikálního stavu substrátů a produktů nebo energetického účinku. Nejčastěji se však dělí podle typu a počtu složek, které se na nich podílejí a podle toho rozlišujeme reakce syntézní, rozkladné a vytěsňovací.
Co je to Reaktant
Reaktant je látka nebo látky, které vstupují do chemické reakce a mění se na produkt nebo produkty. Během reakce se reaktanty spotřebovávají. Reaktantem mohou být prvky nebo chemické sloučeniny. V biochemii, zejména v souvislosti s enzymatickými reakcemi, se reaktanty běžně nazývají substráty.
Čím se zabývá reakční kinetika : se zabývá rychlostí chemických reakcí.
Látky, které do reakce vstupují, nazýváme reaktanty. Látky, které z reakce vystupují, nazýváme produkty. Při tomto procesu dochází ke změnám v rozmístění elektronové hustoty v molekule, zjednodušeně řečeno, dochází k zániku a vzniku chemických vazeb. Chemické reakce popisujeme pomocí chemických rovnic.
Methyl (methylová skupina) je hydrofobní alkylovou funkční skupinou. Methyl vzniká odtržením jednoho vodíkového atomu z methanu. Má souhrnný vzorec -CH3. Někdy se ve vzorcích označuje jako Me.
Co to je reakční teplo
Reakční teplo se vyjadřuje pomocí veličiny enthalpie. Je to teplo, které soustava přijme či uvolní za stálého tlaku a teploty při jednotkovém látkovém rozsahu reakce. Absolutní hodnotu nelze změřit, lze pouze stanovit změnu enthalpie ΔH, která je vyjadřována za standardních podmínek (t = 25 °C, p = 101,325 kPa).Typy reakcí
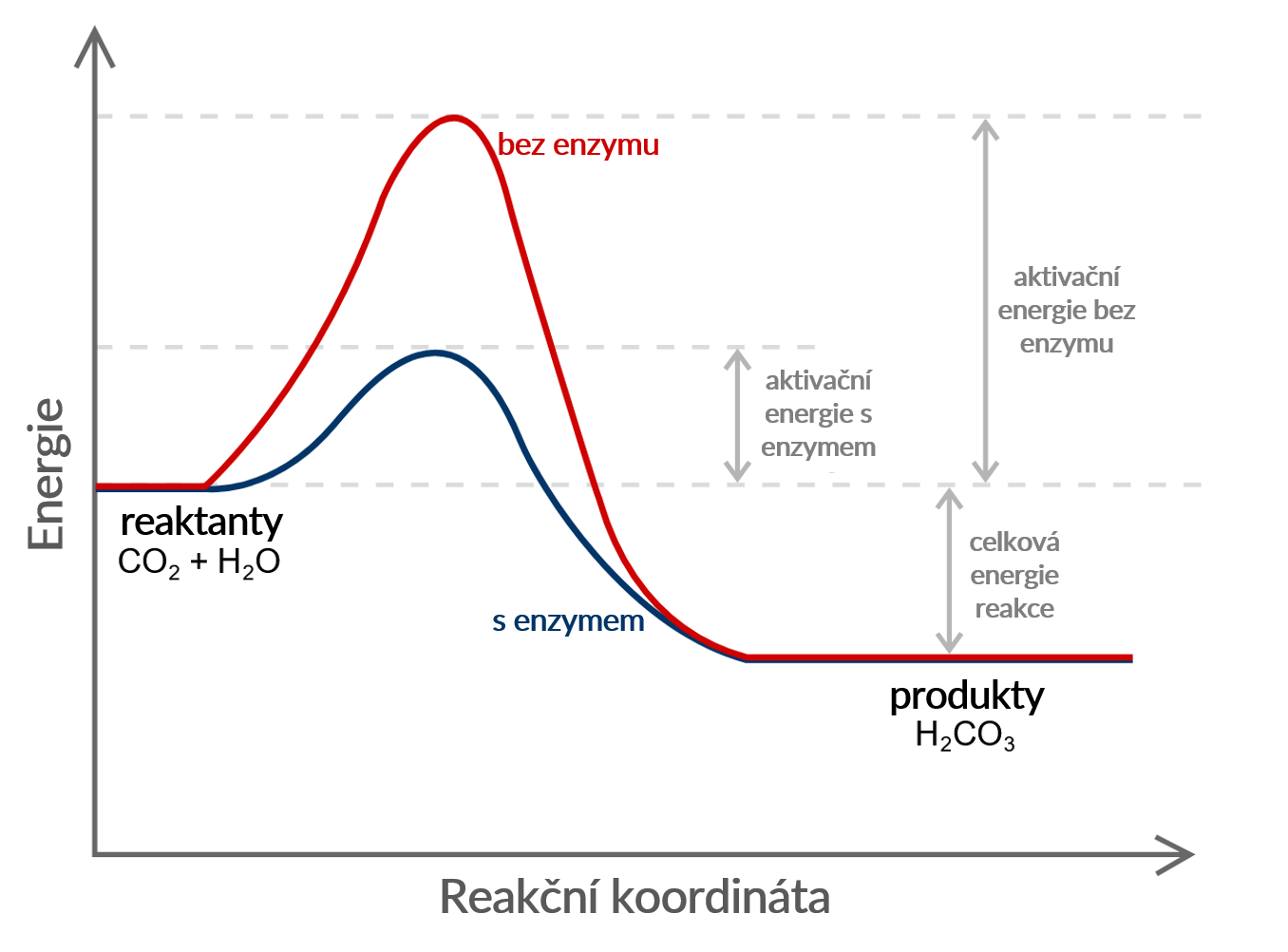
Termochemie se zabývá studiem tepelného zabarvení chemických reakcí. Dle tepelného zabarvení dělíme reakce na exotermní (teplo se uvolňuje) a endotermní (teplo se spotřebovává). V termochemické rovnici se uvádí symboly skupenství u prvků či sloučenin, protože hodnoty reakčního tepla závisí i na skupenství.
Chemická vazba
Co je to Presmyk : Přesmyk je stavba (vedení kolejí) umožňující přejezd vlaků mezi kolejemi/tratěmi bez narušení jízdy vlaků jedoucích po jiné koleji.
Jaká je reakční doba : Celková reakční doba pak závisí na úhlu zaměření pohledu a pohybuje se od zhruba 0,4 do 1,5 s. Průměrná reakční doba přes pedál je 1,2 s a přes volant 0,9 s. U trénovaných řidičů může být nižší a naopak u rozptylovaných řidičů vyšší. Rozptylovat může telefonování, psaní zpráv, hudba a jiné příčiny.
Co je to CH2
Ethen (triviální názvy: ethylen, etylén) je nejjednodušším zástupcem uhlovodíků ze skupiny alkenů. Je to bezbarvý hořlavý plyn nasládlé vůně s teplotou tání −169,1 °C. Se vzduchem tvoří výbušnou směs. Bývá obsažen v zemním a koksárenském plynu, dále se získává krakováním.
CH2/CH3 je sklápěcí vanová zástěna, jež je důkladně technickypropracována a díky tomu ji lze pohodlně sklápět. Vybírat můžete z dvoudílného provedení – CH2 či trojdílného provedení – CH3.Reakční teplo ze spalných tepel se vypočítá jako součet spalných tepel reaktantů (vynásobených stechiometrickými koeficienty), od kterých jsou odečtena spalná tepla produktů (též vynásobená příslušnými koeficienty). Reakční teplo reakce je -52 kJ⋅mol−1.
Jak se značí reakční teplo : Reakční teplo se vyjadřuje pomocí veličiny enthalpie. Vyjadřuje teplo, které soustava přijme či uvolní za stálého tlaku v rozsahu jednoho molu. Absolutní hodnotu nelze změřit, lze pouze stanovit změnu enthalpie ΔH, která je vyjadřována za standardních podmínek (t = 25 °C, p = 101,325 kPa).