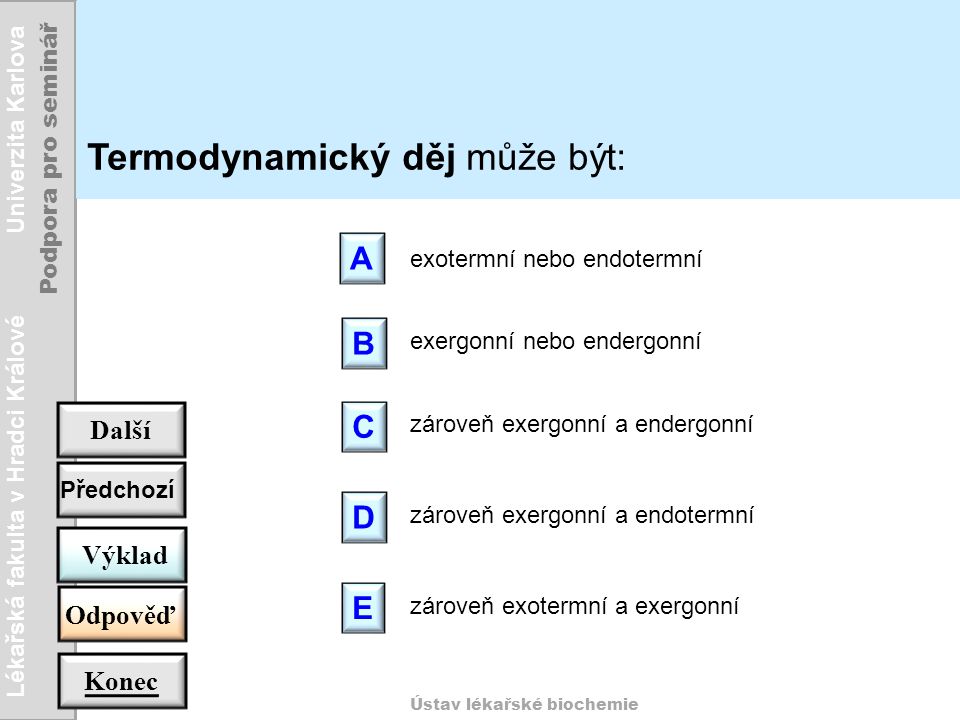
Jestliže se při chemické reakci uvolňuje teplo, hovoříme o reakci exotermní (exotermické). Exotermní reakce jsou mnohdy doprovázeny světelnými efekty či prudkým zvýšením teploty reakční směsi. Tyto reakce probíhají většinou samovolně, jejich nejběžnějším příkladem je hoření.Exotermická (exotermní) reakce (z řeckého ἔξω exo „venku“ a θερμός thermós „teplý, horký, vyhřívaný“) je chemická reakce, při níž se uvolňuje energie, obvykle ve formě tepla. Produkty reakce proto mají nižší chemickou energii než reaktanty, které do reakce vstoupily.Endotermická (endotermní) reakce (z řeckého ἔξω endo „dovnitř“ a θερμός thermós „teplý, horký, vyhřívaný“) je chemická reakce, při níž se energie spotřebovává, obvykle ve formě tepla. Produkty reakce proto mají vyšší chemickou energii než reaktanty, které do reakce vstoupily.
Jak poznat typ reakce : Typy reakcí
přímá – vznik produktů
zpětná – reakce produktů za vzniku výchozích látek.
vratná – přímá a zpětná reakce probíhají vzájemně
Jak dělíme Termochemické reakce
Termochemie se zabývá studiem tepelného zabarvení chemických reakcí. Dle tepelného zabarvení dělíme reakce na exotermní (teplo se uvolňuje) a endotermní (teplo se spotřebovává). V termochemické rovnici se uvádí symboly skupenství u prvků či sloučenin, protože hodnoty reakčního tepla závisí i na skupenství.
Jaký typ reakce je hoření : Hoření je fyzikálně chemická reakce, při které hořlavá látka reaguje vysokou rychlostí s oxidačním prostředkem za vzniku tepla a světla. Je to reakce exotermická.
Reakční teplo ze spalných tepel se vypočítá jako součet spalných tepel reaktantů (vynásobených stechiometrickými koeficienty), od kterých jsou odečtena spalná tepla produktů (též vynásobená příslušnými koeficienty). Reakční teplo reakce je -52 kJ⋅mol−1.
Standardní slučovací teplo
Je reakčním teplem reakce, při kterém vznikne 1 mol sloučeniny z prvků. Podmínkou vzniku je standardní stav prvků i produktů, to je teplota 298,15 K, tlak 101,325 kPa. Standardní slučovací tepla prvků jsou vždy nulová.
Jak poznáme že se jedná o redoxní reakcí
Redoxní reakce poznáme podle toho, že při nich dochází ke změně oxidačních čísel reaktantů. Redoxní reakce můžeme rozdělit na dvě dílčí poloreakce příslušející oxidaci a redukci. Při vyčíslování redoxních rovnic musíme dbát nejen na bilanci prvků, ale i na bilanci náboje, k tomu nám může pomoci metoda poloreakcí.Reakce, v nichž se několik reaktantů slučuje za vzniku jednoho produktu, se nazývají skladné neboli slučovací reakce (slučování), zatímco v rozkladné reakci (rozkladu) se jeden reaktant rozkládá na více produktů.Modrý plamen bezuhlíkatých látek nebo látek s nízkým obsahem uhlíku – např. hořící vodík, síra, oxid uhelnatý, částečně ethanol (plamen modrý do žluta) apod.
Optimální teplota pro rozklad dřeva začíná od 280 °C. Při nižší teplotě hoření vznikají látky, které jsou zdraví velmi škodlivé a poškozují korozí vnitřek kamen nebo kotle. Při teplotě nad 700 °C se ze dřeva uvolňuje a hoří dřevoplyn (směs kysličníku uhelnatého a vodíku s vysokou výhřevností).
Jak poznat redukci a oxidaci : 1. Při oxidaci se atom zbavuje záporných elektronů, jeho oxidační číslo se tedy zvyšuje a stává se kladnějším! 2. Při redukci atom přijímá záporné elektrony, jeho oxidační číslo se tedy snižuje a stává se zápornějším!
Co to je Redox : Oxidačně-redukční (redox) potenciál je složený parametr celkové intenzity oxidačních nebo redukčních podmínek v systému a odráží stupeň vyváženosti mezi oxidačními a redukčními procesy.
Jak poznat poměr vylučovací
POMĚR VYLUČOVACÍ (značka V)
Poměr vylučovací znamená, že obsah druhé věty vylučuje možnosti věty první. Řečeno zjednodušeně – jestliže platí jedna možnost, pak neplatí druhá a naopak. Např. Buď se budu odpoledne dívat na televizi, nebo půjdu se spolužačkou ven.
Slučovací poměr je vyjadřován např. spojkami a, i, ani, ještě, popř. kombinací spojky a příslovce a také, dvojčlennými spojkami ani – ani, tu – tu, zčásti – zčásti, dílem – dílem, hned – hned apod. Příklady: Prověřil jsem je (fakta) a zvážil a také jsem k nim možná pár dalších připojil sám.Zelená: Dusičnan barnatý. Yellow : Calcium carbonate. Žlutá: Uhličitan vápenatý.
Proč se barví plamen : Jak můžeme plamen obarvit Světlo plamene vznikne, když se částice horkého plynu (pro zjednodušení uvažujme o atomech) zbavují energie. Protože přesně dané spektrum barev, kterými může atom svítit, je pro každý prvek jiné, existují prvky u kterých výrazně převáží jedna barva.
Antwort Jak poznat Exotermni reakcí? Weitere Antworten – Jak poznat exotermní reakci
Exotermní reakce
Jestliže se při chemické reakci uvolňuje teplo, hovoříme o reakci exotermní (exotermické). Exotermní reakce jsou mnohdy doprovázeny světelnými efekty či prudkým zvýšením teploty reakční směsi. Tyto reakce probíhají většinou samovolně, jejich nejběžnějším příkladem je hoření.Exotermická (exotermní) reakce (z řeckého ἔξω exo „venku“ a θερμός thermós „teplý, horký, vyhřívaný“) je chemická reakce, při níž se uvolňuje energie, obvykle ve formě tepla. Produkty reakce proto mají nižší chemickou energii než reaktanty, které do reakce vstoupily.Endotermická (endotermní) reakce (z řeckého ἔξω endo „dovnitř“ a θερμός thermós „teplý, horký, vyhřívaný“) je chemická reakce, při níž se energie spotřebovává, obvykle ve formě tepla. Produkty reakce proto mají vyšší chemickou energii než reaktanty, které do reakce vstoupily.
Jak poznat typ reakce : Typy reakcí
Jak dělíme Termochemické reakce
Termochemie se zabývá studiem tepelného zabarvení chemických reakcí. Dle tepelného zabarvení dělíme reakce na exotermní (teplo se uvolňuje) a endotermní (teplo se spotřebovává). V termochemické rovnici se uvádí symboly skupenství u prvků či sloučenin, protože hodnoty reakčního tepla závisí i na skupenství.
Jaký typ reakce je hoření : Hoření je fyzikálně chemická reakce, při které hořlavá látka reaguje vysokou rychlostí s oxidačním prostředkem za vzniku tepla a světla. Je to reakce exotermická.
Reakční teplo ze spalných tepel se vypočítá jako součet spalných tepel reaktantů (vynásobených stechiometrickými koeficienty), od kterých jsou odečtena spalná tepla produktů (též vynásobená příslušnými koeficienty). Reakční teplo reakce je -52 kJ⋅mol−1.

Standardní slučovací teplo
Je reakčním teplem reakce, při kterém vznikne 1 mol sloučeniny z prvků. Podmínkou vzniku je standardní stav prvků i produktů, to je teplota 298,15 K, tlak 101,325 kPa. Standardní slučovací tepla prvků jsou vždy nulová.
Jak poznáme že se jedná o redoxní reakcí
Redoxní reakce poznáme podle toho, že při nich dochází ke změně oxidačních čísel reaktantů. Redoxní reakce můžeme rozdělit na dvě dílčí poloreakce příslušející oxidaci a redukci. Při vyčíslování redoxních rovnic musíme dbát nejen na bilanci prvků, ale i na bilanci náboje, k tomu nám může pomoci metoda poloreakcí.Reakce, v nichž se několik reaktantů slučuje za vzniku jednoho produktu, se nazývají skladné neboli slučovací reakce (slučování), zatímco v rozkladné reakci (rozkladu) se jeden reaktant rozkládá na více produktů.Modrý plamen bezuhlíkatých látek nebo látek s nízkým obsahem uhlíku – např. hořící vodík, síra, oxid uhelnatý, částečně ethanol (plamen modrý do žluta) apod.

Optimální teplota pro rozklad dřeva začíná od 280 °C. Při nižší teplotě hoření vznikají látky, které jsou zdraví velmi škodlivé a poškozují korozí vnitřek kamen nebo kotle. Při teplotě nad 700 °C se ze dřeva uvolňuje a hoří dřevoplyn (směs kysličníku uhelnatého a vodíku s vysokou výhřevností).
Jak poznat redukci a oxidaci : 1. Při oxidaci se atom zbavuje záporných elektronů, jeho oxidační číslo se tedy zvyšuje a stává se kladnějším! 2. Při redukci atom přijímá záporné elektrony, jeho oxidační číslo se tedy snižuje a stává se zápornějším!
Co to je Redox : Oxidačně-redukční (redox) potenciál je složený parametr celkové intenzity oxidačních nebo redukčních podmínek v systému a odráží stupeň vyváženosti mezi oxidačními a redukčními procesy.
Jak poznat poměr vylučovací
POMĚR VYLUČOVACÍ (značka V)
Poměr vylučovací znamená, že obsah druhé věty vylučuje možnosti věty první. Řečeno zjednodušeně – jestliže platí jedna možnost, pak neplatí druhá a naopak. Např. Buď se budu odpoledne dívat na televizi, nebo půjdu se spolužačkou ven.
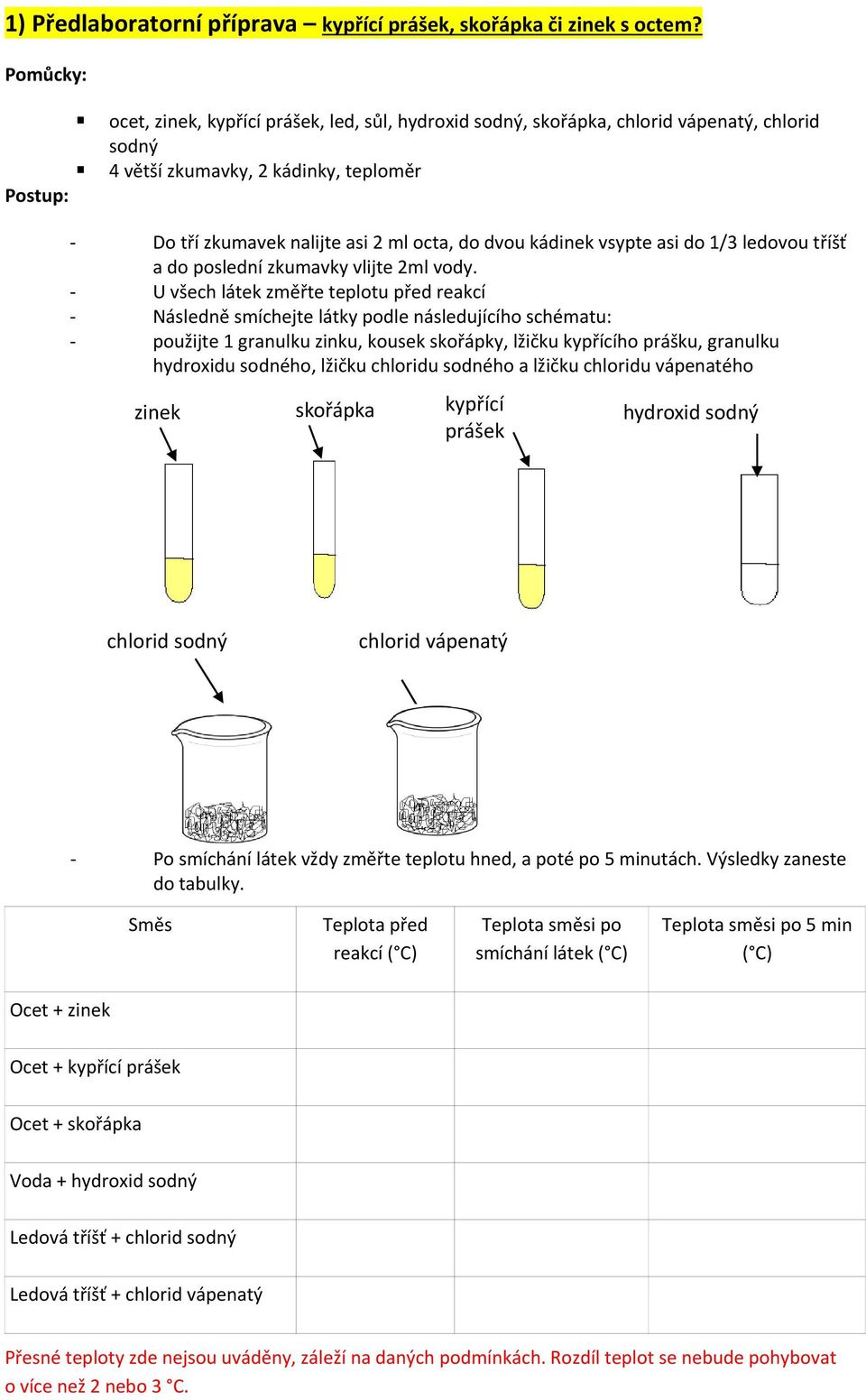
Slučovací poměr je vyjadřován např. spojkami a, i, ani, ještě, popř. kombinací spojky a příslovce a také, dvojčlennými spojkami ani – ani, tu – tu, zčásti – zčásti, dílem – dílem, hned – hned apod. Příklady: Prověřil jsem je (fakta) a zvážil a také jsem k nim možná pár dalších připojil sám.Zelená: Dusičnan barnatý. Yellow : Calcium carbonate. Žlutá: Uhličitan vápenatý.
Proč se barví plamen : Jak můžeme plamen obarvit Světlo plamene vznikne, když se částice horkého plynu (pro zjednodušení uvažujme o atomech) zbavují energie. Protože přesně dané spektrum barev, kterými může atom svítit, je pro každý prvek jiné, existují prvky u kterých výrazně převáží jedna barva.